(2010?潮州二模)Ⅰ.某学校探究性学习小组对84消毒液(有效成份:NaClO溶液)的制备与性质等进行以下探究.
甲同学:为制备84消毒液,制作了一种家用环保型消毒液发生器,设计了如图1所示的装置,用石墨作电极电解饱和氯化钠.请填空:
(1)若通电时,为使生成的Cl
2被完全吸收,制得有较强杀菌能力的消毒液,则电源的a极名称为
负
负
极(填“正”、“负”),连接a极的电极反应式为
2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-
2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-
.
(2)用图示的装置电解饱和食盐水制备84消毒液(NaClO溶液)的离子方程式为
Cl
-+H
2O
ClO
-+H
2↑或2Cl
-+2H
2O
2OH
-+H
2↑+Cl
2↑、Cl
2+2OH
-=ClO
-+Cl
-+H
2O
Cl
-+H
2O
ClO
-+H
2↑或2Cl
-+2H
2O
2OH
-+H
2↑+Cl
2↑、Cl
2+2OH
-=ClO
-+Cl
-+H
2O
.
乙同学:从某超市中查询到某品牌消毒液包装说明的部分内容摘录如下:
主要有效成份为次氯酸钠,有效氯含量8000-10000mg/L.可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用.切勿用于丝绸、毛、尼龙、皮革、油漆表面,勿用于铝、铜、碳钢制品.本品须密封,置阴凉暗处保存.
请完成以下实验探究过程:
阅读材料,根据学过的知识判断问题:
(3)室温条件下,该消毒液(NaClO)溶液的pH>7,原因是(用离子方程式表示)
ClO-+H2O?HClO+OH-
ClO-+H2O?HClO+OH-
.
(4)查得弱酸的电离常数:H
2CO
3K
1=4.4×10
-7,K
2=4.7×10
-11;HClO K=3×10
-8.
从该消毒液的保存要求分析,导致其失效的主要原因是(用化学方程式表示):
NaClO+CO
2+H
2O=NaHCO
3+HClO、2HClO
2HCl+O
2↑
NaClO+CO
2+H
2O=NaHCO
3+HClO、2HClO
2HCl+O
2↑
.
Ⅱ.Mg(ClO
3)
2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl
2+2NaClO
3═Mg(ClO
3)
2+2NaCl
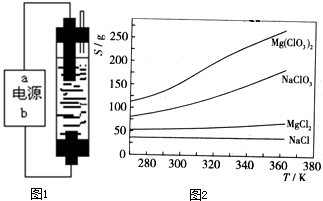
已知四种化合物的溶解度(S)随温度(T)变化曲线如图2所示:
①将反应物按化学反应方程式计量数比混合制备Mg(ClO
3)
2.简述可制备Mg(ClO
3)
2的原因:
在某一温度时,NaCl最先达到饱和析出,Mg(ClO3)2的溶解度随温度变化的最大,NaCl的溶解度与其他物质的溶解度有一定的差别
在某一温度时,NaCl最先达到饱和析出,Mg(ClO3)2的溶解度随温度变化的最大,NaCl的溶解度与其他物质的溶解度有一定的差别
.
②按①中条件进行制备实验.在冷却降温析出Mg(ClO
3)
2过程中,常伴有NaCl析出,原因是:
降温前,溶液中NaCl已达饱和,降温过程中,NaCl溶解度会略为降低,会有少量晶体析出
降温前,溶液中NaCl已达饱和,降温过程中,NaCl溶解度会略为降低,会有少量晶体析出
.





