
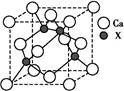
 <
< GaAs+3CH4
GaAs+3CH4

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
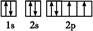
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
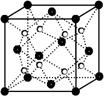
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
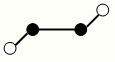

| A.该晶体属于分子晶体 |
| B.此晶体的硬度比金刚石还大 |
| C.晶体的化学式是X3Y4 |
| D.晶体熔化时破坏共价键 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH—C≡N是制备腈纶的原料,其分子中σ键和π键的个数之比为 (填最简整数比),写出该分子中所有碳原子的杂化方式 。
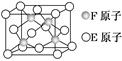
CH—C≡N是制备腈纶的原料,其分子中σ键和π键的个数之比为 (填最简整数比),写出该分子中所有碳原子的杂化方式 。  为碳原子,
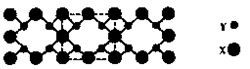
为碳原子, 为硅原子)。每个碳原子周围与其距离最近的硅原子有 个。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为 (用含a、b的式子表示)。
为硅原子)。每个碳原子周围与其距离最近的硅原子有 个。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为 (用含a、b的式子表示)。 
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com