
| A������Һ��pH=13 |
| B����������NaOH����Һ��c(NH4+)��С��Kw��С |
| C����AlCl3��Һ��Ӧ�����ӷ���ʽΪ Al3++3OH�D=Al(OH)3�� |
| D���μ�0.10 mol��L-1HNO3��Һ��pH=7����Һ������Ũ�ȹ�ϵΪ��c (NO3�D) = c(NH4+)> c(H+)=c(OH�D) |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��F- | B��ClO- | C��HSO3- | D��NH4+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��pH��1����Һ�У�Fe2����NO3-��SO42-��Na�� |
| B����ɫ��Һ�У�K����Fe3����SO42-��SCN�� |
| C��c (H��)/c (OH��) = 1012����Һ�У�NH4+��Al3����NO3-��Cl�� |
| D����ˮ�����c (H��)��1��10��14 mol/L����Һ�У�Ca2����K����Cl����HCO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��CaCO3�ĵ��뷽��ʽ��CaCO3��Ca2+��CO32�� |
B��HCO3���ĵ��뷽��ʽ��HCO3����H2O H3O����CO32�� H3O����CO32�� |
C��CO32����ˮ�ⷽ��ʽ��CO32����2H2O H2CO3��2OH�� H2CO3��2OH�� |
| D��CaCO3�ij����ܽ�ƽ�����ʽ��CaCO3��s����Ca2+��aq����CO32����aq�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ��� | NH3��H2O | HCl | �����Һ��pHֵ |
| �� | c��NH3��H2O��=0.1mol��L-1 | c��HCl��=0.1mol��L-1 | pH=a |
| �� | NH3��H2O��pH=12 | HCl��pH=2 | pH=b |
| �� | c��NH3��H2O��="A" mol��L-1 | c��HCl��=0.1mol��L-1 | pH=c |
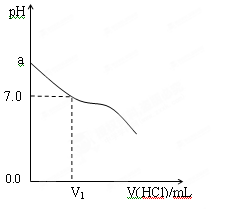
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| n(SO32��):n(HSO3��) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
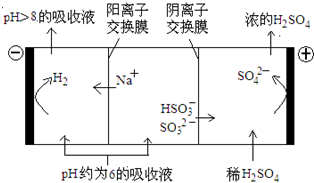
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��OH�D��CO32�D��SO42�D | B��S2�D��Cl�D��SO42�D |
| C��CO32�D��NO3�D��S2�D | D��Cl�D��SO42�D��NO3�D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��һ������Mg2+��Al3+��Cl��������Na+��NH4+ |
| B��һ������Na+��Mg2+��Cl��������NH4+�����ܺ���Al3+ |
| C��c (Cl��) Ϊ 4.00 mol��L-1��c (Al3+) Ϊ1.00 mol��L-1 |
| D��c (Mg2+) Ϊ 1.00 mol��L-1��c(Na+ ) Ϊ 0.50 mol��L-1 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com