
【题目】制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是
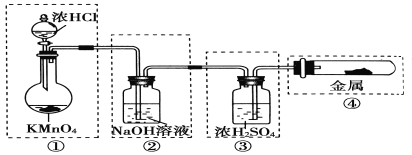
A. ①② B. ② C. ②③ D. ②③④
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 标准状况下,11.2LSO2气体中含氧原子数等于18g水中含有的氧原子数
B. 5.6 g铁与足量稀硫酸反应失去的电子的物质的最为0.3 mol
C. 100g98%的浓硫酸所含的氧原子个数为4mol
D. 20gNaOH溶于1L水,所得溶液中c(Na+)=0.5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1mol/LCH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+对于该平衡,下列叙述正确的是( )
CH3COO-+H+对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是重要的溶剂和替代燃料,工业上常以CO和H2的混合气体为原料在一定条件下制备甲醇。
(1)工业上可以通过下列途径获得H2,其中节能效果最好的是___________。
A.高温分解水制取H2:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B.电解水制取H2:2 H2O![]() 2H2↑+ O2↑
2H2↑+ O2↑
C.甲烷与水反应制取H2:CH4+ H2O![]() 3H2+CO
3H2+CO
D.在光催化剂作用下,利用太阳能分解水制取H2:2H2O![]() 2H2↑+ O2↑
2H2↑+ O2↑
(2)在2L的密闭容器中充入1mo1 CO和2mol H2,一定条件下发生反应;CO(g)+2H2(g) ![]() CH3OH(g),测得CO和CH3OH(g)的物质的量随时间的变化如下图所示。
CH3OH(g),测得CO和CH3OH(g)的物质的量随时间的变化如下图所示。
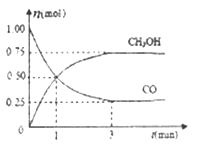
①从反应开始到平衡,氢气的平均反应速率v(H2)=_____,平衡时氢气的体积分数为____。
②能够判断该反应达到平衡的是______。
A. CO、H2和CH3OH三种物质的浓度相等
B. 密闭容器中混合气体的密度不再改变
C. 密闭容器中混合气体的平均相对分子质量不再改变
D. 相同时间内消耗1mo1CO,同时消耗1mol CH3OH
(3)为使合成甲醇原料的原子利用率达到100%,实际生产中制备水煤气时还需使用CH4,则生产投料时,n(C):n(H2O):n(CH4)=__________。
(4)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用一个月才充电一次。假定放电过程中,甲醇完全氧化产生的二氧化碳被充分吸收生成CO32-。则该电池负极的电极反应式为__________________,电池放电过程中溶液的pH将_____(填“下降”、“上升”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知白磷和P4O6的分子结构如图所示,又知化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量,现查知P—P键能为198 kJ·mol-1、P—O键能为360 kJ·mol-1、O===O键能为498 kJ·mol-1。若生成1 mol P4O6,则反应P4(白磷)+3O2=P4O6中的能量变化为( )
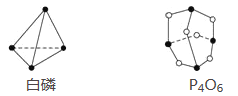
A. 吸收1 638 kJ能量 B. 放出1 638 kJ能量
C. 吸收126 kJ能量 D. 放出126 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化过程中,原物质内仅有共价键被破坏,同时有离子键形成的是( )
A. 盐酸和NaOH溶液反应
B. 氯化氢溶于水
C. 稀硫酸与BaCl2溶液反应
D. 氯化氢与氨气反应生成NH4Cl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图中所示的实验方法、装置或操作正确的是( )
|
|
A.测量锌与稀硫酸反应的速率 | B.证明非金属性:Cl>C>Si |
|
|
C.进行酸碱中和滴定实验 | D.测定中和热 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 16g CH4含有的原子数为NA
B. 17 g OH- 含有的质子数为9NA
C. 2g D2气体中含有的中子数为0.5 NA
D. 标准状况下22.4 L NH3含有的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知某元素的原子结构示意图: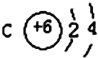 则可知:该元素原子的电子层数为:______,最外层电子数为:______,该元素在周期表的位置是第______周期第______族。
则可知:该元素原子的电子层数为:______,最外层电子数为:______,该元素在周期表的位置是第______周期第______族。
(2)已知某元素的原子结构示意图: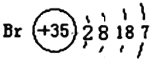 则可知:该元素原子的电子层数为:______,最外层电子数为:______,该元素在周期表的位置是第______周期第______族。
则可知:该元素原子的电子层数为:______,最外层电子数为:______,该元素在周期表的位置是第______周期第______族。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com