
����Ŀ���״�(CH3OH)����Ҫ���ܼ������ȼ�ϣ���ҵ�ϳ���CO��H2�Ļ������Ϊԭ����һ���������Ʊ��״���
(1)��ҵ�Ͽ���ͨ������;�����H2�����н���Ч����õ���___________��
A.���·ֽ�ˮ��ȡH2:2H2O![]() 2H2��+O2��
2H2��+O2��
B.���ˮ��ȡH2:2 H2O![]() 2H2��+ O2��
2H2��+ O2��
C.������ˮ��Ӧ��ȡH2:CH4+ H2O![]() 3H2+CO
3H2+CO
D.�ڹ���������£�����̫���ֽܷ�ˮ��ȡH2:2H2O![]() 2H2��+ O2��
2H2��+ O2��
(2)��2L���ܱ������г���1mo1 CO��2mol H2��һ�������·�����Ӧ;CO(g)+2H2(g) ![]() CH3OH(g)�����CO��CH3OH(g)�����ʵ�����ʱ��ı仯����ͼ��ʾ��
CH3OH(g)�����CO��CH3OH(g)�����ʵ�����ʱ��ı仯����ͼ��ʾ��
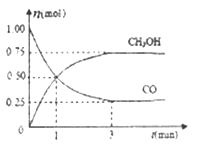
�ٴӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2)=_____��ƽ��ʱ�������������Ϊ____��
���ܹ��жϸ÷�Ӧ�ﵽƽ�����______��
A. CO��H2��CH3OH�������ʵ�Ũ�����
B. �ܱ������л��������ܶȲ��ٸı�
C. �ܱ������л�������ƽ����Է����������ٸı�
D. ��ͬʱ��������1mo1CO��ͬʱ����1mol CH3OH
(3)Ϊʹ�ϳɼ״�ԭ�ϵ�ԭ�������ʴﵽ100%��ʵ���������Ʊ�ˮú��ʱ����ʹ��CH4��������Ͷ��ʱ��n(C):n(H2O):n(CH4)=__________��
(4)�ݱ��������Ħ��������˾�з���һ���ɼ״��������Լ�ǿ�����������Һ�������ֻ���أ����������������غ�﮵�ص�10����������ʹ��һ���²ų��һ�Ρ��ٶ��ŵ�����У��״���ȫ���������Ķ�����̼�������������CO32-����õ�ظ����ĵ缫��ӦʽΪ__________________����طŵ��������Һ��pH��_____(�����½�����������������������)��
���𰸡�D 0.25 molL-1min-1 33.3% CD 1��2��1 CH3OH - 6e- + 8OH- =CO32-+6H2O �½�
��������
��1��ͨ����ͬ;�����H2�����Լ��Դ��������̫���ܣ�
��2���ٸ���![]() ����v��CO�����ٸ�������֮�ȵ���ϵ��֮�ȼ���v��H2������������ʽ�������������������
����v��CO�����ٸ�������֮�ȵ���ϵ��֮�ȼ���v��H2������������ʽ�������������������
��ƽ���־�����淴Ӧ������ͬ������ֺ������䣻
��3��Ϊʹ�ϳɼ״�ԭ�ϵ�ԭ�������ʴ�100%��������n��C����n��H����n��O��=1��4��1���ݴ˷�����
��4���ŵ�ʱ������ӦΪ��CH3OH-6e-+8OH-=CO32-+6H2O�������缫��Ӧʽ��O2+2H2O+4e-=4OH-����ط�ӦΪ2CH3OH+3O2+4OH-=2CO32-+6H2O���ݴ˷�������
��1��ͨ����ͬ;�����H2�����Լ��Դ��������̫���ܣ���������ѡ���������ܡ����ܣ�������Ҫ�ʴ�Ϊ��D��
��2���ٴӷ�Ӧ��ʼ��ƽ�⣬��n(CO)=1mol0.25mol=0.75mol����v(CO)=![]() =0.125mol/(Lmin)���ɷ���ʽ�Ŀ�֪v(H2)=2v(CO)=2��0.125mol/(Lmin)=0.25mol/(Lmin)��
=0.125mol/(Lmin)���ɷ���ʽ�Ŀ�֪v(H2)=2v(CO)=2��0.125mol/(Lmin)=0.25mol/(Lmin)��
�г�����ʽ���£�
 �����������������=
�����������������=![]() =
=![]() =33.3%���ʴ�Ϊ��0.25mol/(Lmin)��33.3%��
=33.3%���ʴ�Ϊ��0.25mol/(Lmin)��33.3%��
��A. CO��H2��CH3OH�������ʵ�Ũ����Ȳ�һ���ﵽƽ�⣬A�����
B. ��Ӧǰ���������䣬���Ҳ���䣬���ܱ������л��������ܶ�һֱ���䣬���Բ�һ���ﵽƽ�⣬B�����
C. �ܱ��������������䣬��������ƽ����Է����������ٸı䣬˵���ܵ����ʵ������䣬��÷�Ӧ�������������С����ϵ���ʻ�������ƽ����Է����������ٸı䣬��˵����Ӧ�ﵽƽ�⣬C����ȷ��
D. ��ͬʱ��������l mol CO��ͬʱ����1molCH3OH�������淴Ӧ������ȣ���˵����Ӧ�ﵽƽ�⣬D����ȷ��
�ʴ�Ϊ��CD��
��3��Ϊʹ�ϳɼ״�ԭ�ϵ�ԭ�������ʴ�100%,������n(C):n(H):n(O)=1:4:1,����n(C):n(H2O):n(CH4)=1:2:1���ʴ�Ϊ��1:2:1��
��4����1���ŵ�����У��״���ȫ����������CO2�������������CO32-����õ�ظ����ĵ缫��ӦʽΪCH3OH - 6e- + 8OH- =CO32-+6H2O��
��2���ŵ�ʱ���״���������Ϊ��ظ�����Ӧ�����������������õ��ӵĻ�ԭ��Ӧ���䷴Ӧ���ܷ���ʽΪ��2CH3OH+3O2+4OH-=2CO32-+6H2O����֪��������������OH-���������ҺpH���½���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����һ��������N2��H2��Ӧ����NH3����ش�
������Ӧ���������ΪE1���������������ΪE2����E1��E2����÷�ӦΪ________(����ȡ����ȡ�)��Ӧ��
����֪��1molH��H����1molN��H����1molN��N���ֱ���Ҫ��������436kJ��391kJ��946kJ����N2��H2��Ӧ����NH3���Ȼ�ѧ����ʽΪ___________________________________________��
��2��ʵ������50mL0.50mol��L��1������50mLijŨ�ȵ�NaOH��Һ����ͼ��ʾװ���з�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ���װ�����������ԵĴ�������һ����ȱ��һ�ֲ���������������������Ϊ___________________________��ʵ�����ṩ��0.50mol��L��1��0.55mol��L��1����Ũ�ȵ�NaOH��Һ��Ӧѡ��___________mol��L��1��NaOH��Һ����ʵ�顣

��3������������CO2���ڻ��ۣ���в����̬����������������ܵ�ȫ�����ע����ҵ�ϳ��ø�Ũ�ȵ�K2CO3��Һ����CO2������ҺX�������õ�ⷨʹK2CO3��Һ��������װ��ʾ��ͼ���£�

���������������ķ�Ӧ����__________________________________��H����HCO===H2O��CO2����
�ڼ���CO![]() ��������������ԭ����____________________________________��
��������������ԭ����____________________________________��
��4�������£���NaOH��Һ����SO2�õ�pH��9��Na2SO3��Һ���Լ�����Һ��![]() ��_______����������H2SO3�ĵ���ƽ�ⳣ��Ka1��1.0��10��2��Ka2��6.0��10��8��
��_______����������H2SO3�ĵ���ƽ�ⳣ��Ka1��1.0��10��2��Ka2��6.0��10��8��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʵ����ϵ������ȷ����( )
A. H2��D2 �� T2 ��Ϊͬλ��B. ![]() ��
�� ![]() ��Ϊͬ���칹��
��Ϊͬ���칹��
C. ���ʯ��C60��ʯī��Ϊͬ��������D. (CH3)2CHCH2CH3 �� CH3CH2CH(CH3)2 ����ͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ�ÿɼ��������ҵ��ˮ�к������ӣ�NH4+��������˵������ȷ����
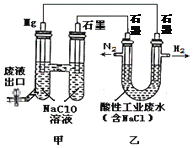
A. ���ǵ���ת��Ϊ��ѧ�ܵ�װ��
B. ������������ʱ�����ӷ���ʽΪ��3Cl2 + 2NH4+=N2 + 6Cl-+8H+
C. ������H2��N2�����ʵ���֮��Ϊ3:1���������ˮ��pH��С
D. ��ع���ʱ���׳��е�Na������Mg�缫
���𰸡�D
��������A�����л��ý���þ��ԭ��صĸ�����ʯīΪ�����γ�ԭ��أ���������ԭ��صĵ��أ�������Թ�ҵ��ˮ�������ǽ�����ת��Ϊ��ѧ�ܵ�װ�ã�ѡ��A��ȷ��B�����������º�����������ʱת��Ϊ��������Ӧ�����ӷ���ʽΪ��3Cl2 + 2NH4+=N2 + 6Cl-+8H+��ѡ��B��ȷ��C��������H2��N2�����ʵ���֮��Ϊ3:1�����ݵ缫��Ӧ6H++6e-=3H2����3Cl2 + 2NH4+=N2 + 6Cl-+8H+���������ˮ��H+Ũ������pH��С��ѡ��C��ȷ��D����ع���ʱ���׳���ԭ��أ�ԭ�����������Na����������ʯī�缫��ѡ��D����ȷ����ѡD��
�����͡���ѡ��
��������
7
����Ŀ����֪ij���������Һ�п��ܺ���NO3- ��Cl- ��SO42-��CO32-��NH4+��Fe3+��Al3+��K+�еļ��֣������������ӵ����ʵ�����ȡ�Ϊȷ������Һ�ijɷ֣�ijѧϰС����������ʵ�飺��ȡ����Һ100mL���������NaOH��Һ�����ȵõ�0.02mol���壬ͬʱ�������ɫ������ �ڽ��������ˡ�ϴ�ӡ����գ��õ�1.6 g���壻 ����������Һ�м�������BaCl2��Һ���õ�4.66 g����������ij���������˵����ȷ����
A. ����ȷ��ԭ��Һ���Ƿ���Al3+��K+
B. ԭ��Һ�к��е�����ֻ�У�Cl- ��SO42-��NH4+��Fe3+
C. ԭ��Һ��c(NO3-)��0.2 mol��L-1 c(Fe3+)=0.2 mol��L-1
D. ��ԭ��Һ�м�������������������Һ�����������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڽ������������ȷ���ǣ� ��
A.����������������ɢϵ�ı��������Ƿ�ɢ����ֱ����10-9~10-7m֮��
B.��ƽ�й�����FeCl3��Һ��Fe(OH)3����ʱ�����ܲ������������
C.���м�����±�������ǽ���۳��������еľ���Ӧ��
D.��Һ�����塢��Һ�����ڻ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ�ؼס��ҡ�������������Ԫ�����ڱ��е����λ����ͼ��ʾ������˵����ȷ����
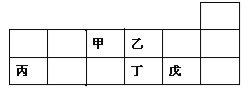
A. ԭ�Ӱ뾶�Ĵ�С˳��Ϊ���ף��ң�������
B. �⻯����ȶ��ԣ��ң������⻯��ķе㣺������
C. Ԫ�ؼ���Ԫ�ر�����������ϼ�֮�͵���ֵ����8
D. Ԫ������������Ӧ��ˮ���������һ���ȶ���ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ʊ��������������������������������ķ�Ӧ��ÿ�����߿��ʾһ����Ԫװ�ã������д������
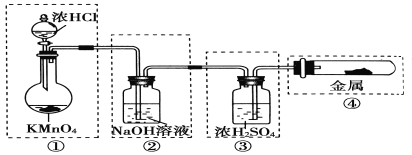
A. �٢� B. �� C. �ڢ� D. �ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��V LŨ��Ϊ0.5 mol��L��1�����ᣬ��ʹ��Ũ������1������ȡ�Ĵ�ʩ��������( )��
A. ͨ���״���µ�HCl����11.2V L
B. ����10 mol��L��1������0.1V L����ϡ����1.5V L
C. ����Һ����Ũ����0.5V L
D. ����V L 1.5 mol��L��1�������Ͼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ�����:
�û�ѧ����ش���������:
(1)д������̼���ӵĵ���ʽ:__________
(2)д���������ӵĽṹʽ��__________
(3)A+��B-��C��D ��������(���ӻ�����),���Ƕ��ֱ�10������,��֪����������ת����ϵ:A++B-![]() C+D��,��A+�ĵ���ʽ:_______;�Ƚ�C��D���ȶ��Ե�ǿ��:_____(�û�ѧʽ��ʾ)
C+D��,��A+�ĵ���ʽ:_______;�Ƚ�C��D���ȶ��Ե�ǿ��:_____(�û�ѧʽ��ʾ)
(4)�õ���ʽ��ʾMgCl2���γɹ���__________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com