
【题目】按要求填空:
用化学用语回答下列问题:
(1)写出二硫化碳分子的电子式:__________
(2)写出氮气分子的结构式:__________
(3)A+、B-、C、D 四种粒子(分子或离子),它们都分别含10个电子,已知它们有如下转化关系:A++B-![]() C+D↑,则A+的电子式:_______;比较C和D的稳定性的强弱:_____(用化学式表示)
C+D↑,则A+的电子式:_______;比较C和D的稳定性的强弱:_____(用化学式表示)
(4)用电子式表示MgCl2的形成过程__________
【答案】![]() N≡N
N≡N ![]() H2O>NH3
H2O>NH3 ![]()
【解析】
(1)二硫化碳分子中碳原子与硫原子之间形成2对共用电子对;
(2)氮气分子中含有1个氮氮三键;
(3)A+、B-、C、D四种粒子(分子或离子),它们都分别含10个电子,且有A++Bˉ![]() C+D↑,则A为铵根离子,B氢氧根离子,C为水,D为氨气,非金属性越强,简单氢化物的稳定性越强;
C+D↑,则A为铵根离子,B氢氧根离子,C为水,D为氨气,非金属性越强,简单氢化物的稳定性越强;
(4)MgCl2是离子化合物,Mg最外层两个电子被两个Cl原子得到。
(1)二硫化碳分子中碳原子与硫原子之间形成2对共用电子对,电子式为![]() ;
;
(2)氮气分子中含有氮氮三键,其结构式为:N≡N;
(3)A+、B-、C、D四种粒子(分子或离子),它们都分别含10个电子,且有A++Bˉ![]() C+D↑,则A为铵根离子,B氢氧根离子,C为水,D为氨气,铵根离子含有四个N-H键,即N与H共用4 对电子,所以电子式为
C+D↑,则A为铵根离子,B氢氧根离子,C为水,D为氨气,铵根离子含有四个N-H键,即N与H共用4 对电子,所以电子式为![]() ,N、O位于第二周期,O的非金属性强,所以水比氨气稳定,即稳定性H2O>NH3;
,N、O位于第二周期,O的非金属性强,所以水比氨气稳定,即稳定性H2O>NH3;
(4)MgCl2属于离子化合物,Mg最外层两个电子被两个Cl原子得到,用电子式表示形成过程为:![]() 。
。


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是重要的溶剂和替代燃料,工业上常以CO和H2的混合气体为原料在一定条件下制备甲醇。
(1)工业上可以通过下列途径获得H2,其中节能效果最好的是___________。
A.高温分解水制取H2:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B.电解水制取H2:2 H2O![]() 2H2↑+ O2↑
2H2↑+ O2↑
C.甲烷与水反应制取H2:CH4+ H2O![]() 3H2+CO
3H2+CO
D.在光催化剂作用下,利用太阳能分解水制取H2:2H2O![]() 2H2↑+ O2↑
2H2↑+ O2↑
(2)在2L的密闭容器中充入1mo1 CO和2mol H2,一定条件下发生反应;CO(g)+2H2(g) ![]() CH3OH(g),测得CO和CH3OH(g)的物质的量随时间的变化如下图所示。
CH3OH(g),测得CO和CH3OH(g)的物质的量随时间的变化如下图所示。
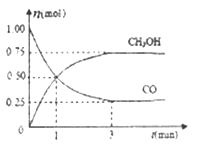
①从反应开始到平衡,氢气的平均反应速率v(H2)=_____,平衡时氢气的体积分数为____。
②能够判断该反应达到平衡的是______。
A. CO、H2和CH3OH三种物质的浓度相等
B. 密闭容器中混合气体的密度不再改变
C. 密闭容器中混合气体的平均相对分子质量不再改变
D. 相同时间内消耗1mo1CO,同时消耗1mol CH3OH
(3)为使合成甲醇原料的原子利用率达到100%,实际生产中制备水煤气时还需使用CH4,则生产投料时,n(C):n(H2O):n(CH4)=__________。
(4)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用一个月才充电一次。假定放电过程中,甲醇完全氧化产生的二氧化碳被充分吸收生成CO32-。则该电池负极的电极反应式为__________________,电池放电过程中溶液的pH将_____(填“下降”、“上升”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 16g CH4含有的原子数为NA
B. 17 g OH- 含有的质子数为9NA
C. 2g D2气体中含有的中子数为0.5 NA
D. 标准状况下22.4 L NH3含有的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的短周期部分,表中字母分别表示一种元素。

请回答下列问题:
(1)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)____。
a.MnO2 b.NaCl c.Na2SO3 d.KMnO4
(2)d、e、h四种元素最高价氧化物对应的水化物的酸性由弱到强的顺序为(用化学式表示)________。b、c、f、g、h形成的简单离子的半径由小到大的顺序为_______(用离子符号填写)。
(3)在1L的密闭容器中,通入1molf2气体和3mola2气体,一定温度下反应生成fa3气体,2min时,测得f2的浓度为0.75mol·L-1,则2min时fa3的物质的量为_____mol;反应达到平衡状态时,若增大fa3的产率,可以采取措施(填序号)_____。
①升高温度 ②恒容充入氦气
③向密闭容器内充入f2气 ④及时分离出fa3气体
(4)d与a可形成化合物d5a12,试写出它的一氯取代物有一种的同分异构体的结构简式_____。
(5)a、d两种元素可形成多种化合物,其中化合物X的产量是衡量一个国家石油化工发展水平的标志。X可与H2O在一定条件下反应生成化合物乙醇,该反应的化学方程式为:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2009年,M IT的唐纳德·撒多维教授领导的小组研制出一种镁锑液态金属储能电池。电池突破了传统电池设计理念,以NaCl、KCl和MgCl2的熔融盐作为电解质。以Mg和Sb两极金属,整个电池在700℃工作,处在液体状态。由于密度的不同,在重力下分层,分别形成上层金属Mg,下层金属Sb和中间的NaCl、KCl及MgCl2电解质层。电池的工作原理如图所示,关于该电池的说法不正确的是 ( )
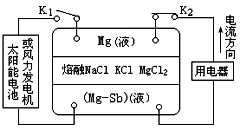
A. 电池充电时Cl—从上向下移动
B. 电池放电时正极的电极反应式为Mg2++2e—=Mg
C. 电池充电时阳极的电极反应式为:2Cl—-2e—=Cl2↑
D. 电池充电时中层熔融盐的组成不发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:

回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是__________,还可使用___________代替硝酸。
(2)沉淀A的主要成分是_________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为____________________________________。
(3)加氨水过程中加热的目的是___________。沉淀B的主要成分为_____________、____________(填化学式)。
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为: ![]() +H++H2C2O4→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为______________。
+H++H2C2O4→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知某元素的原子结构示意图: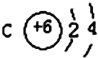 则可知:该元素原子的电子层数为:______,最外层电子数为:______,该元素在周期表的位置是第______周期第______族。
则可知:该元素原子的电子层数为:______,最外层电子数为:______,该元素在周期表的位置是第______周期第______族。
(2)已知某元素的原子结构示意图: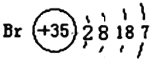 则可知:该元素原子的电子层数为:______,最外层电子数为:______,该元素在周期表的位置是第______周期第______族。
则可知:该元素原子的电子层数为:______,最外层电子数为:______,该元素在周期表的位置是第______周期第______族。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为前20号原子序数依次递增的四种元素,X与Y能形成![]() 和
和![]() 两种常温下呈液态的化合物,Z原子的原子序数为最外层电子数的3倍,等物质的量的单质W所含电子数为化合物
两种常温下呈液态的化合物,Z原子的原子序数为最外层电子数的3倍,等物质的量的单质W所含电子数为化合物![]() 电子数的两倍,则以下说法错误的是
电子数的两倍,则以下说法错误的是
A. 氢化物的稳定性为![]()
B. ![]() 的电子式为
的电子式为![]()
C. ![]() 中既含有共价键又含有离子键
中既含有共价键又含有离子键
D. ![]() 能与
能与![]() 反应生成
反应生成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于药品的使用和作用的说法错误的是( )
A.R表示处方药,OTC表示非处方药
B.毒品就是有毒的药品
C.两千年前的《神农本草经》中就有麻黄能“止咳逆上气”的记载
D.麻黄碱是国际奥委会严格禁止使用的兴奋剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com