
【题目】X、Y、Z、W为前20号原子序数依次递增的四种元素,X与Y能形成![]() 和
和![]() 两种常温下呈液态的化合物,Z原子的原子序数为最外层电子数的3倍,等物质的量的单质W所含电子数为化合物
两种常温下呈液态的化合物,Z原子的原子序数为最外层电子数的3倍,等物质的量的单质W所含电子数为化合物![]() 电子数的两倍,则以下说法错误的是
电子数的两倍,则以下说法错误的是
A. 氢化物的稳定性为![]()
B. ![]() 的电子式为
的电子式为![]()
C. ![]() 中既含有共价键又含有离子键
中既含有共价键又含有离子键
D. ![]() 能与
能与![]() 反应生成
反应生成![]()
【答案】B
【解析】
X、Y、Z、W为前20号原子序数依次递增的四种元素,X与Y能形成X2Y和X2Y2两种常温下呈液态的化合物,X为H元素,Y为O元素;Z原子的原子序数为最外层电子数的3倍,Z为P元素;等物质的量的单质W所含电子数为化合物X2Y电子数的两倍,W为Ca元素,结合对应单质、化合物的性质以及元素周期率解答该题。
由以上分析可以知道X为H元素、Y为O元素、Z为P元素、W为Ca元素。
A.非金属性O>P,元素的非金属性越强,对应的氢化物越稳定,稳定性为![]() ,故A正确;
,故A正确;
B.过氧化氢的电子式为![]() ,故B错误;
,故B错误;
C. CaO2是离子化合物,含有离子键,过氧根中含有共价键,故C正确;
D.CaH2和水反应生成氢气和氢氧化钙,故D正确。
故选B。


科目:高中化学 来源: 题型:
【题目】V L浓度为0.5 mol·L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是( )。
A. 通入标准状况下的HCl气体11.2V L
B. 加入10 mol·L-1的盐酸0.1V L,再稀释至1.5V L
C. 将溶液加热浓缩到0.5V L
D. 加入V L 1.5 mol·L-1的盐酸混合均匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
用化学用语回答下列问题:
(1)写出二硫化碳分子的电子式:__________
(2)写出氮气分子的结构式:__________
(3)A+、B-、C、D 四种粒子(分子或离子),它们都分别含10个电子,已知它们有如下转化关系:A++B-![]() C+D↑,则A+的电子式:_______;比较C和D的稳定性的强弱:_____(用化学式表示)
C+D↑,则A+的电子式:_______;比较C和D的稳定性的强弱:_____(用化学式表示)
(4)用电子式表示MgCl2的形成过程__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①熔融的BaCl2、②H2SO4溶于水、③NH4Cl溶于水、④Na2O2溶液、⑤干冰升华、⑥溴水被CCl4萃取六种物质,按下列要求回答:
(1)化学键没有破坏的是__________,仅破坏共价键的是________,仅破坏离子键的是________,离子键和共价键都破坏的是_____________。
(2)NH4Cl的电子式是________,CO2的结构和CS2相似,请你写出CS2的电子式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2SO3是一种重要的还原剂,I2O5是一种重要的氧化剂,二者都是化学实验室中的重要试剂。
(1)已知:2Na2SO3 (aq)+O2(aq)==2Na2SO4(aq) △H =m kJ·mol-1,O2(g)![]() O2(aq) △H =n kJ·mol-1 ,则Na2SO3溶液与O2(g)反应的热化学方程式为______________________________。
O2(aq) △H =n kJ·mol-1 ,则Na2SO3溶液与O2(g)反应的热化学方程式为______________________________。
(2)Na2SO3的氧化分富氧区和贫氧区两个阶段,贫氧区速率方程为v=k·ca(SO32-)·cb(O2),k为常数。
①当溶解氧浓度为4.0 mg/L(此时Na2SO3的氧化位于贫氧区)时,c(SO32-)与速率数值关系如下表所示,则a=____。
c(SO32-)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
V×106 | 10.2 | 24.4 | 44.7 | 103.6 |
②两个阶段的速率方程和不同温度的速率常数之比如下表所示。已知1n(k2/k1)=Ea/R(1/T2-1/T1),R 为常数,则Ea(富氧区)______(填“>”或“<”)Ea(贫氧区)。
反应阶段 | 速率方程 | k(297.0K)/k(291.5K) |
富氧区 | v= k·c(SO32-)·c(O2) | 1.47 |
贫氧区 | v= k·ca(SO32-)·cb(O2) | 2.59 |
(3)等物质的量的Na2SO3和Na2SO4混合溶液中,c(SO32-) +c( HSO3-)______(填“>”“<”或“=”)c(SO42-)。
(4)利用I2O5可消除CO 污染,其反应为I2O5(s)+5CO(g) ![]() 5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2 L 恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2) 随时间t的变化曲线如图所示。
5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2 L 恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2) 随时间t的变化曲线如图所示。

①从反应开始至a点时的平均反应速率v(CO)=__________。
②b点时,CO 的转化率为_____________。
③b点 和 d点 的 化学 平衡常数:Kb____(填“ >”“<”或“=” )Kd,判断的理由是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
(1)锌片上发生的电极反应:___________________;
(2)银片上发生的电极反应:____________________;
(3)总反应的离子方程式:_________________;
(4)在______片上有气泡产生,电子从______片上流向_______片上。
(5)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算产生氢气的体积(标准状况)为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某容积一定的密闭容器中充入2molSO2和1molO2,一定条件下发生如下反应:2SO2+O2![]() 2SO3。下列说法不正确的是
2SO3。下列说法不正确的是
A. 升高温度或充入一定量O2均能加快化学反应速率
B. 达到平衡状态时,SO2、O2、SO3物质的量之比一定为2:1:2
C. 当SO2的生成速率与SO3的生成速率相等时,反应达到平衡状态
D. 达到平衡状态时,生成SO3的物质的量一定小于2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可通过反应;3Cl2+6KOH![]() 5KCl+KC1O3+3H2O 制取KC1O3,再用稍潮湿的KC1O3和草酸(H2C2O4) 在60℃时反应制取ClO2气体,装置如图所示。ClO2是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。
5KCl+KC1O3+3H2O 制取KC1O3,再用稍潮湿的KC1O3和草酸(H2C2O4) 在60℃时反应制取ClO2气体,装置如图所示。ClO2是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。
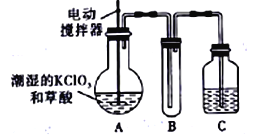
请回答下列问题:
(1)A 中反应的主要产物有:某种正盐、ClO2和CO2等,写出该反应的化学方程式:_______________________________。
(2)请分析装置图,进行补充和完善。A部分缺___________装置,B部分还应补充____________装置,还有一处设计明显不合理的是___________(填“A”“B”或“C”)
(3)C中的试剂为NaOH溶液时,反应生成NaClO3和NaClO2,写出该反应的离于方程式:______________________________________。
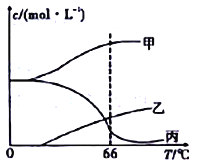
(4)在密闭容器中向9℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是______________;继续通入适量Cl2,将溶液加热,溶液中主要离子的浓度随温度的变化如图所示,图中甲、乙、丙依次表示的离子是____________________(不考虑Cl2的挥发)
(5)测定KClO3样品中C1O3-的含量,称取样品ag,准确配制成1000mL溶液,从上述溶液中取出10.00mL 于锥形瓶中,准确加入30.00mL 1.00 molL-1 (NH4)2Fe(SO4)2溶液(过量)。再在锥形瓶中加入100mL 蒸馏水及某种指示剂,用0.200 molL-1K2Cr2O7标准溶液滴定至终点,消耗5.00mL。样品中C1O3-的质量分数为_________。(已知Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O,C1O3-可被Fe2+还原为Cl-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com