
【题目】Na2SO3是一种重要的还原剂,I2O5是一种重要的氧化剂,二者都是化学实验室中的重要试剂。
(1)已知:2Na2SO3 (aq)+O2(aq)==2Na2SO4(aq) △H =m kJ·mol-1,O2(g)![]() O2(aq) △H =n kJ·mol-1 ,则Na2SO3溶液与O2(g)反应的热化学方程式为______________________________。
O2(aq) △H =n kJ·mol-1 ,则Na2SO3溶液与O2(g)反应的热化学方程式为______________________________。
(2)Na2SO3的氧化分富氧区和贫氧区两个阶段,贫氧区速率方程为v=k·ca(SO32-)·cb(O2),k为常数。
①当溶解氧浓度为4.0 mg/L(此时Na2SO3的氧化位于贫氧区)时,c(SO32-)与速率数值关系如下表所示,则a=____。
c(SO32-)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
V×106 | 10.2 | 24.4 | 44.7 | 103.6 |
②两个阶段的速率方程和不同温度的速率常数之比如下表所示。已知1n(k2/k1)=Ea/R(1/T2-1/T1),R 为常数,则Ea(富氧区)______(填“>”或“<”)Ea(贫氧区)。
反应阶段 | 速率方程 | k(297.0K)/k(291.5K) |
富氧区 | v= k·c(SO32-)·c(O2) | 1.47 |
贫氧区 | v= k·ca(SO32-)·cb(O2) | 2.59 |
(3)等物质的量的Na2SO3和Na2SO4混合溶液中,c(SO32-) +c( HSO3-)______(填“>”“<”或“=”)c(SO42-)。
(4)利用I2O5可消除CO 污染,其反应为I2O5(s)+5CO(g) ![]() 5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2 L 恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2) 随时间t的变化曲线如图所示。
5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2 L 恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2) 随时间t的变化曲线如图所示。

①从反应开始至a点时的平均反应速率v(CO)=__________。
②b点时,CO 的转化率为_____________。
③b点 和 d点 的 化学 平衡常数:Kb____(填“ >”“<”或“=” )Kd,判断的理由是_____________________。
【答案】 2Na2SO3(aq)+O2(g)=2Na2SO4(aq) ΔH=(m+n)kJ/mol 2 < < 0.6mol/(L·min) 80% > 其他条件相同时,曲线II先达到平衡,温度高于曲线I的,说明温度升高CO2的产率降低,平衡向逆反应方向移动,平衡常数减小
【解析】(1)①2Na2SO3 (aq)+O2(aq)==2Na2SO4(aq) △H =m kJ·mol-1 ,②O2(g)![]() O2(aq) △H =n kJ·mol-1,根据盖斯定律,将①+②得:2Na2SO3(aq)+O2(g)=2Na2SO4(aq) ΔH=(m+n)kJ/mol,故答案为:2Na2SO3(aq)+O2(g)=2Na2SO4(aq) ΔH=(m+n)kJ/mol;
O2(aq) △H =n kJ·mol-1,根据盖斯定律,将①+②得:2Na2SO3(aq)+O2(g)=2Na2SO4(aq) ΔH=(m+n)kJ/mol,故答案为:2Na2SO3(aq)+O2(g)=2Na2SO4(aq) ΔH=(m+n)kJ/mol;
(2)①当溶解氧浓度为4.0mgL-1时,c(Na2SO3)与速率数值关系如表,v1:v2=c1a(SO32-):c2a(SO32-), ![]() =
=![]() ,解得a=2;故答案为:2;
,解得a=2;故答案为:2;
②ln![]() =
=![]() (
(![]() -
-![]() )随着Ea的增大而增大,富氧区的ln
)随着Ea的增大而增大,富氧区的ln![]() 较小,故Ea(富氧区)<Ea(贫氧区);故答案为:<;
较小,故Ea(富氧区)<Ea(贫氧区);故答案为:<;
(3) 等物质的量的Na2SO3和Na2SO4混合溶液中,Na2SO3属于强碱弱酸盐,水解显碱性,根据物料守恒,c(SO32-)+c(HSO3-)+ c(H2SO3)= c(SO42-),则c(SO32-)+c(HSO3-)<c(SO42-),故答案为:<;
(4)①0到0.5min时:
5CO(g)+I2O5(s)5CO2(g)+I2(s)
起始量/mol 2 0
转化量/mol x x
a点量/mol 2-x x
根据a点时CO2的体积分数φ(CO2)= ![]() =0.30,得x=0.6mol,则从反应开始至a点时的反应速率为v(CO)=
=0.30,得x=0.6mol,则从反应开始至a点时的反应速率为v(CO)=  =0.6molL-1min-1,故答案为:0.6molL-1min-1;
=0.6molL-1min-1,故答案为:0.6molL-1min-1;
② 5CO(g)+I2O5(s)
起始量/mol 2 0
转化量/mol y y
b点量/mol 2-y y
根据a点时CO2的体积分数φ(CO2)= ![]() =0.80,得y=1.6mol,转化率等于=
=0.80,得y=1.6mol,转化率等于=![]() ×100%=80%,故答案为:80%;
×100%=80%,故答案为:80%;
③其他条件相同时,曲线II先达到平衡,温度高于曲线I的,说明温度升高CO2的产率降低,平衡向逆反应方向移动,平衡常数减小,则化学平衡常数:Kb>Kd,故答案为:>;其他条件相同时,曲线II先达到平衡,温度高于曲线I的,说明温度升高CO2的产率降低,平衡向逆反应方向移动,平衡常数减小。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列图中所示的实验方法、装置或操作正确的是( )
|
|
A.测量锌与稀硫酸反应的速率 | B.证明非金属性:Cl>C>Si |
|
|
C.进行酸碱中和滴定实验 | D.测定中和热 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2009年,M IT的唐纳德·撒多维教授领导的小组研制出一种镁锑液态金属储能电池。电池突破了传统电池设计理念,以NaCl、KCl和MgCl2的熔融盐作为电解质。以Mg和Sb两极金属,整个电池在700℃工作,处在液体状态。由于密度的不同,在重力下分层,分别形成上层金属Mg,下层金属Sb和中间的NaCl、KCl及MgCl2电解质层。电池的工作原理如图所示,关于该电池的说法不正确的是 ( )
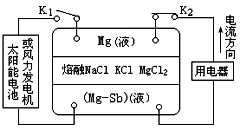
A. 电池充电时Cl—从上向下移动
B. 电池放电时正极的电极反应式为Mg2++2e—=Mg
C. 电池充电时阳极的电极反应式为:2Cl—-2e—=Cl2↑
D. 电池充电时中层熔融盐的组成不发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知某元素的原子结构示意图: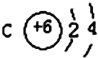 则可知:该元素原子的电子层数为:______,最外层电子数为:______,该元素在周期表的位置是第______周期第______族。
则可知:该元素原子的电子层数为:______,最外层电子数为:______,该元素在周期表的位置是第______周期第______族。
(2)已知某元素的原子结构示意图: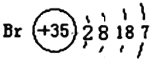 则可知:该元素原子的电子层数为:______,最外层电子数为:______,该元素在周期表的位置是第______周期第______族。
则可知:该元素原子的电子层数为:______,最外层电子数为:______,该元素在周期表的位置是第______周期第______族。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为前20号原子序数依次递增的四种元素,X与Y能形成![]() 和
和![]() 两种常温下呈液态的化合物,Z原子的原子序数为最外层电子数的3倍,等物质的量的单质W所含电子数为化合物
两种常温下呈液态的化合物,Z原子的原子序数为最外层电子数的3倍,等物质的量的单质W所含电子数为化合物![]() 电子数的两倍,则以下说法错误的是
电子数的两倍,则以下说法错误的是
A. 氢化物的稳定性为![]()
B. ![]() 的电子式为
的电子式为![]()
C. ![]() 中既含有共价键又含有离子键
中既含有共价键又含有离子键
D. ![]() 能与
能与![]() 反应生成
反应生成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是先用浓硫酸与乙醇反应制取乙烯,再由乙烯与Br2反应制备1,2-二溴乙烷(熔点:9.5℃,沸点:131℃)的反应装置(加热和加持装置略去),下列说法错误的是( )
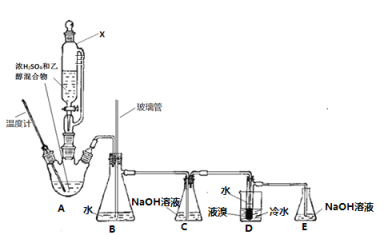
A. 仪器X使用前要先拔掉上口的玻璃塞
B. 装置B的作用是防堵塞安全作用
C. 若略去装置C,会使液溴部分损耗
D. 装置E是尾气处理装置,主要吸收尾气中的溴蒸气,防止污染环境
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】x、y、z、w、n为五种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示:
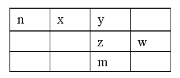
请回答下列问题:
(1)w位于周期表中第__________周期,第__________族。
(2)n、z、w、三种元素最高价氧化物水化物的酸性由弱到强的顺序为:__________(用化学式表示)。
(3)下列事实能说明y元素的非金属性比z元素的非金属性强的是____
A.y单质与z的气态氢化物水溶液反应,溶液变浑浊
B.在氧化还原反应中,1moly单质比1molz得电子多
C.y和z两元素的简单氢化物受热分解,前者的分解温度高
D.y元素最高价氧化物水化物酸性比z元素最高价氧化物水化物酸性强
(4)y和氢元素形成的10电子微粒中常见![]() 价阳离子为__________(填化学式);z和氢元素形成的18电子微粒中常见
价阳离子为__________(填化学式);z和氢元素形成的18电子微粒中常见![]() 价阴离子的电子式为__________。
价阴离子的电子式为__________。
(5)化合物nyz存在于天然气中,可以用NaOH溶液洗涤除去。化合物nyz的电子式为__________,其与NaOH溶液反应除生成两种正盐外,还有水生成,其化学方程式为__________。
(6)m元素的原子序数为__________,它是一种__________。(填“金属”或“非金属”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,对该物质的说法正确的是

A. 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B. 滴入酸性KMnO4溶液,观察紫色褪去,能证明结构中存在碳碳双键
C. 1 mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为6 mol、7 mol
D. 该分子中的所有碳原子可能共平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com