
【题目】下列物质中只含有非极性共价键的是
A. C12 B. MgC12 C. H2O D. KOH
科目:高中化学 来源: 题型:
【题目】某化工厂为了综合利用生产过程中的副产品CaSO4,与相邻的合成氨厂联合设计了以下制备(NH4)22SO4的工艺流程:
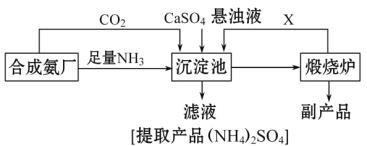
请回答以下问题:
(1)工业合成氨反应的条件是_____________________。沉淀池中发生的主要反应方程式是________________________。该反应能够发生的原因是__________________________。
(2)提纯滤液以获得(NH4)2SO4晶体,必要的操作步骤是:__________(填序号)。
A.萃取 B.蒸发浓缩 C.冷却结晶 D.蒸馏
(3)上述生产流程中,有关NH3的作用及说明正确的是:__________(填序号)。
A.提供制备所需的氮元素
B.增大CO32-的浓度促进反应发生
C.作反应的催化剂
D.生产1 mol (NH4)2SO4,至少消耗2 mol NH3
(4)该生产过程中的副产品是_______________,从绿色化学和资源综合利用的角度说明上述流程的主要优点是______________.缺点是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:

回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是__________,还可使用___________代替硝酸。
(2)沉淀A的主要成分是_________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为____________________________________。
(3)加氨水过程中加热的目的是___________。沉淀B的主要成分为_____________、____________(填化学式)。
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为: ![]() +H++H2C2O4→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为______________。
+H++H2C2O4→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烷(![]() -C2H5)可生产塑料单体苯乙烯(
-C2H5)可生产塑料单体苯乙烯(![]() -CH=CH2),其原理反应是:
-CH=CH2),其原理反应是:![]() -C2H5(g)
-C2H5(g) ![]()
![]() -CH=CH2(g) + H2(g);△H = +125 kJ·mol-1。某温度下,将0.40 mol
-CH=CH2(g) + H2(g);△H = +125 kJ·mol-1。某温度下,将0.40 mol![]() -C2H5(g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表:
-C2H5(g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n( | 0.40 | 0.30 | 0.26 | n2 | n3 |
n( | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)n1=__________mol,计算该反应的平衡常数,K=___________。
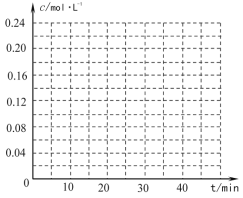
(2)工业上常以高温水蒸气作为反应体系的稀释剂(不参与反应)。![]() -C2H5(g)的平衡转化率与水蒸气的用量、体系总压强的关系如图所示。当其它条件不变时,水蒸气的用量越大,平衡转化率将_________(填“越大”、“越小”或“不变”),原因是____________。
-C2H5(g)的平衡转化率与水蒸气的用量、体系总压强的关系如图所示。当其它条件不变时,水蒸气的用量越大,平衡转化率将_________(填“越大”、“越小”或“不变”),原因是____________。

(3)副产物H2用做氢氧燃料电池。写出酸性条件下,该电池正极的电极反应式__________。
(4)在相同条件下,若最初向该容器中充入![]() -CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图中画出并标明该条件下
-CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图中画出并标明该条件下![]() -C2H5(g)和
-C2H5(g)和![]() -CH=CH2(g)的浓度c随时间t变化的曲线_____。
-CH=CH2(g)的浓度c随时间t变化的曲线_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为前20号原子序数依次递增的四种元素,X与Y能形成![]() 和
和![]() 两种常温下呈液态的化合物,Z原子的原子序数为最外层电子数的3倍,等物质的量的单质W所含电子数为化合物
两种常温下呈液态的化合物,Z原子的原子序数为最外层电子数的3倍,等物质的量的单质W所含电子数为化合物![]() 电子数的两倍,则以下说法错误的是
电子数的两倍,则以下说法错误的是
A. 氢化物的稳定性为![]()
B. ![]() 的电子式为
的电子式为![]()
C. ![]() 中既含有共价键又含有离子键
中既含有共价键又含有离子键
D. ![]() 能与
能与![]() 反应生成
反应生成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生探究0.25mol/L Al2( SO4)3溶液与0.5mol/L Na2CO3溶液的反应,实验如下:

下列分析不正确的是
A. 实验I中,白色沉淀a是Al(OH)3
B. 实验2中,白色沉淀b含有CO32-
C. 实验l、2中,白色沉淀成分不同的原因与混合后溶液的pH无关
D. 检验白色沉淀a、b足否洗涤干净,均可用盐酸酸化的BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平.B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78.回答下列问题:
(1)A的电子式 ______________ ,A的结构简式 _______________ .
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式 ______________________,反应类型_______________。
(3)在碘水中加入B振荡静置后的现象_________________________
(4)B与浓H2SO4与浓HNO3在50-60℃反应的化学反应方程式 ________________________,反应类型______________________。
(5)等质量的A、B完全燃烧时消耗O2的物质的量______(填“A>B”或“A<B”或“A=B”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为探究草酸亚铁(FeC2O4)的热分解产物,按下面所示装置进行实验。以下说法错误的是
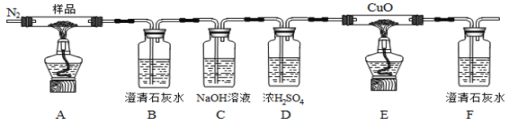
A. 实验中观察到装置B、F中石灰水变浑浊,E中固体变为红色,则证明分解产物中有CO2和CO气体
B. 反应结束后,取A中固体溶于稀硫酸,向其中滴加1~2滴KSCN溶液,溶液无颜色变化,证明分解产物中不含Fe2O3
C. 装置C的作用是除去混合气中的CO2
D. 反应结束后,应熄灭A、E处酒精灯后,持续通入N2直至温度恢复至室温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示。下列关于整个反应过程中的叙述错误的是

A. Oa段反应的化学方程式是Ba(OH)2+CO2 =BaCO3↓+H2O
B. bc段与cd段所消耗CO2的体积相同
C. bc段反应的离子方程式是2AlO2-+3H2O+CO2 = 2Al(OH)3↓+CO32-
D. de段沉淀减少是由于BaCO3固体的消失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com