
【题目】将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
(1)锌片上发生的电极反应:___________________;
(2)银片上发生的电极反应:____________________;
(3)总反应的离子方程式:_________________;
(4)在______片上有气泡产生,电子从______片上流向_______片上。
(5)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算产生氢气的体积(标准状况)为___________________。
【答案】Zn-2e-=Zn2+ 2H++2e-=H2↑ Zn+2H+=Zn2++H2↑ 银 锌 银 4.48L
【解析】
锌片、银片、稀硫酸构成原电池,活泼金属锌作负极,负极上失电子发生氧化反应,银作正极,正极上得电子发生还原反应,结合得失电子守恒分析解答。
(1)锌片、银片、稀硫酸构成原电池,锌比银活泼,锌作负极,负极上锌失电子发生氧化反应,电极反应式为:Zn-2e-=Zn2+,故答案为:Zn-2e-=Zn2+;
(2)锌比银活泼,锌作负极,银作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(3)锌作负极,负极上锌失电子发生氧化反应,电极反应式为:Zn-2e-=Zn2+,银作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,总反应的离子方程式为Zn+2H+=Zn2++H2↑,故答案为:Zn+2H+=Zn2++H2↑;
(4)银作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,银片上有气泡,锌作负极,银作正极,电子从锌片经过导线流向银片,故答案为:银;锌;银;
(5)该原电池中,负极上锌失电子变成锌离子进入溶液,导致质量减少,正极上金属不参加反应,所以该装置中减少的质量是锌的质量,根据电子守恒,生成氢气的物质的量和锌的物质的量相等,所以生成气体的体积=![]() ×22.4L/mol=4.48L,故答案为:4.48L。
×22.4L/mol=4.48L,故答案为:4.48L。


科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 16g CH4含有的原子数为NA
B. 17 g OH- 含有的质子数为9NA
C. 2g D2气体中含有的中子数为0.5 NA
D. 标准状况下22.4 L NH3含有的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知某元素的原子结构示意图: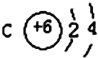 则可知:该元素原子的电子层数为:______,最外层电子数为:______,该元素在周期表的位置是第______周期第______族。
则可知:该元素原子的电子层数为:______,最外层电子数为:______,该元素在周期表的位置是第______周期第______族。
(2)已知某元素的原子结构示意图: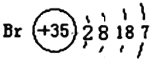 则可知:该元素原子的电子层数为:______,最外层电子数为:______,该元素在周期表的位置是第______周期第______族。
则可知:该元素原子的电子层数为:______,最外层电子数为:______,该元素在周期表的位置是第______周期第______族。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为前20号原子序数依次递增的四种元素,X与Y能形成![]() 和
和![]() 两种常温下呈液态的化合物,Z原子的原子序数为最外层电子数的3倍,等物质的量的单质W所含电子数为化合物
两种常温下呈液态的化合物,Z原子的原子序数为最外层电子数的3倍,等物质的量的单质W所含电子数为化合物![]() 电子数的两倍,则以下说法错误的是
电子数的两倍,则以下说法错误的是
A. 氢化物的稳定性为![]()
B. ![]() 的电子式为
的电子式为![]()
C. ![]() 中既含有共价键又含有离子键
中既含有共价键又含有离子键
D. ![]() 能与
能与![]() 反应生成
反应生成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是先用浓硫酸与乙醇反应制取乙烯,再由乙烯与Br2反应制备1,2-二溴乙烷(熔点:9.5℃,沸点:131℃)的反应装置(加热和加持装置略去),下列说法错误的是( )
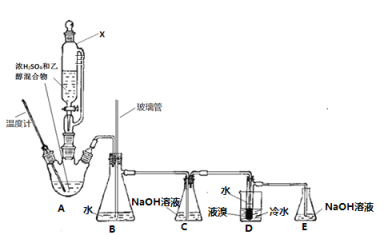
A. 仪器X使用前要先拔掉上口的玻璃塞
B. 装置B的作用是防堵塞安全作用
C. 若略去装置C,会使液溴部分损耗
D. 装置E是尾气处理装置,主要吸收尾气中的溴蒸气,防止污染环境
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平.B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78.回答下列问题:
(1)A的电子式 ______________ ,A的结构简式 _______________ .
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式 ______________________,反应类型_______________。
(3)在碘水中加入B振荡静置后的现象_________________________
(4)B与浓H2SO4与浓HNO3在50-60℃反应的化学反应方程式 ________________________,反应类型______________________。
(5)等质量的A、B完全燃烧时消耗O2的物质的量______(填“A>B”或“A<B”或“A=B”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】x、y、z、w、n为五种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示:
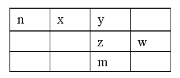
请回答下列问题:
(1)w位于周期表中第__________周期,第__________族。
(2)n、z、w、三种元素最高价氧化物水化物的酸性由弱到强的顺序为:__________(用化学式表示)。
(3)下列事实能说明y元素的非金属性比z元素的非金属性强的是____
A.y单质与z的气态氢化物水溶液反应,溶液变浑浊
B.在氧化还原反应中,1moly单质比1molz得电子多
C.y和z两元素的简单氢化物受热分解,前者的分解温度高
D.y元素最高价氧化物水化物酸性比z元素最高价氧化物水化物酸性强
(4)y和氢元素形成的10电子微粒中常见![]() 价阳离子为__________(填化学式);z和氢元素形成的18电子微粒中常见
价阳离子为__________(填化学式);z和氢元素形成的18电子微粒中常见![]() 价阴离子的电子式为__________。
价阴离子的电子式为__________。
(5)化合物nyz存在于天然气中,可以用NaOH溶液洗涤除去。化合物nyz的电子式为__________,其与NaOH溶液反应除生成两种正盐外,还有水生成,其化学方程式为__________。
(6)m元素的原子序数为__________,它是一种__________。(填“金属”或“非金属”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于药品的使用和作用的说法错误的是( )
A.R表示处方药,OTC表示非处方药
B.毒品就是有毒的药品
C.两千年前的《神农本草经》中就有麻黄能“止咳逆上气”的记载
D.麻黄碱是国际奥委会严格禁止使用的兴奋剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X中可能含有下列离子中的若干种:Cl、SO42、SO32、HCO3、Na+、Mg2+、Fe3+,为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如下实验,下列说法不正确的是

A. 气体A可能是CO2或SO2
B. 溶液X中一定存在SO42
C. 溶液X中一定不存在Fe3+和Mg2+,可能存在Na+
D. 向溶液A加入硝酸酸化的硝酸银溶液可能生成白色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com