
| A. | W的最高价氧化物对应的水化物难溶于水 | |
| B. | 原子半径按X、Y、Z、R、W的顺序依次增大 | |
| C. | Z与Y形成的化合物是碱性氧化物 | |
| D. | WY2能与强碱溶液反应,但不能与任何酸反应 |
分析 X、Y、Z、W、R五种短周期元素原子序数依次增大,X原子是所有原子中半径最小的,则X为H元素,Y原子的最外层电子数是次外层的3倍,则Y有2个电子层,最外层电子数为6,故Y为O元素,Y、R同主族,故R为S元素,Z、W、R同周期,即处于第三周期,Z是常见的金属,其氢氧化物能溶于强碱溶液但不溶于氨水,则Z为Al,W单质是人类将太阳能转变为电能的常用材料,则W为Si.
解答 解:X、Y、Z、W、R五种短周期元素原子序数依次增大,X原子是所有原子中半径最小的,则X为H元素,Y原子的最外层电子数是次外层的3倍,则Y有2个电子层,最外层电子数为6,故Y为O元素,Y、R同主族,故R为S元素,Z、W、R同周期,即处于第三周期,Z是常见的金属,其氢氧化物能溶于强碱溶液但不溶于氨水,则Z为Al,W单质是人类将太阳能转变为电能的常用材料,则W为Si.
A.W的最高价氧化物对应的水化物为硅酸,难溶于水,故A正确;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故半径X(H)<Y(O)<R(S)<W(Si)<Z(Al),故B错误;
C.Z与Y形成的化合物是氧化铝,属于两性氧化物,故C错误;
D.SiO2能与强碱溶液反应,能与氢氟酸反应,故D错误.
故选:A.
点评 本题考查了结构性质位置关系、元素周期律、元素化合物的性质等,推断元素是解题的关键,注意基础知识的掌握,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | d元素的非金属性最强 | |
| B. | 它们均存在两种或两种以上的氧化物 | |
| C. | a可与c、d元素分别形成离子化合物 | |
| D. | b、c、d在化学反应中均易得到电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A原子的最外层电子数比B原子最外层电子数少 | |
| B. | 常温下,A能从冷水中置换出氢气,而B不能 | |
| C. | 等物质的量A和B与足量稀硫酸反应,产生氢气的量A比B多 | |
| D. | A原子的电子层数比B原子电子层数多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加某一反应物的用量一定能够加快该反应的速率 | |
| B. | 化学反应的限度是不可改变的 | |
| C. | 化学反应进行的时间越长该反应的限度越大 | |
| D. | 化学反应达到限度时,正逆反应速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
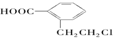 ,A在一定条件下有如图所示的转化关系.已知E分子式为C9H8O2.
,A在一定条件下有如图所示的转化关系.已知E分子式为C9H8O2.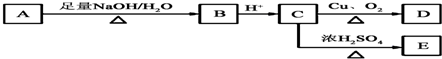
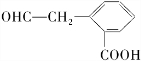 ,若E能使溴的四氯化碳溶液褪色,还能与NaHCO3溶液反应生成F,欲由A通过一步反应得到F,该反应的化学方程式是
,若E能使溴的四氯化碳溶液褪色,还能与NaHCO3溶液反应生成F,欲由A通过一步反应得到F,该反应的化学方程式是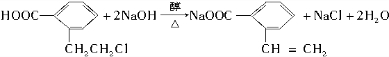 .
. ,写出所有符合下列要求的E的同分异构体的结构简式:
,写出所有符合下列要求的E的同分异构体的结构简式: 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 NH4++OH-;实验室制备A的氢化物的化学方程式为Ca(OH)2+2NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O.
NH4++OH-;实验室制备A的氢化物的化学方程式为Ca(OH)2+2NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com