
分析 (1)根据化合价升降总数相等和质量守恒来配平方程式;
(2)根据化合价升高的反应物是还原剂,其对应产物为氧化产物来回答;
(3)根据电子转移情况和参加反应的各个物质的量之间的关系来计算即可.
解答 解:(1)H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,反应的方程式为2KMnO4+5H2S+3H2SO4=K2SO4+2MnSO4+5S↓+8H2O,
故答案为:2;5;3;1;2;5;8;
(2)H2S中S的化合价由-2价升高为0价,是还原剂,所以对应的产物S 是氧化产物,KMnO4被还原生成还原产物为MnSO4;
故答案为:H2S;MnSO4;
(3)1molH2S在反应中失电子为2mol,若参与反应的H2S为3.4g即0.1mol,则转移的电子数目为0.2NA;
故答案为:0.2NA.
点评 本题主要考查了氧化还原反应的配平、基本概念、电子得失守恒的运用,题目难度不大,注意基础知识的掌握,侧重于考查学生的分析能力和计算能力.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | W的最高价氧化物对应的水化物难溶于水 | |
| B. | 原子半径按X、Y、Z、R、W的顺序依次增大 | |
| C. | Z与Y形成的化合物是碱性氧化物 | |
| D. | WY2能与强碱溶液反应,但不能与任何酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ba2+、Cl-、SO42- | B. | Fe2+、H+、S2-、ClO- | ||
| C. | Mg2+、NH4+、Cl-、SO42- | D. | K+、OH-、NO3-、HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
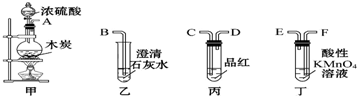
| A. | 按气流从左向右流向,连接装置的正确顺序是A→C→D→F→E→B | |
| B. | 丁中溶液褪色,乙中溶液变浑浊说明甲中生成CO2 | |
| C. | 丙中品红溶液不褪色,乙中溶液变浑浊说明甲中生成CO2 | |
| D. | 丁和丙中溶液都褪色,乙中溶液变浑浊,说明甲中有CO2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中共含有11个极性键 | B. | 分子中含有配位键 | ||
| C. | 分子中只含σ键 | D. | 分子中含有1个π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
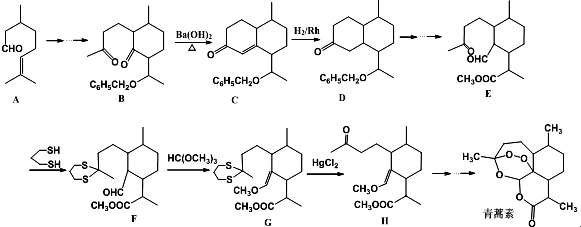
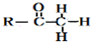 +
+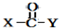 $\stackrel{OH-}{→}$
$\stackrel{OH-}{→}$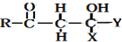
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com