
【题目】将nmol/L氨水滴入10mL1.0mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示.下列有关说法正确的是( ) 
A.n=1.0
B.水的电离程度:b>c>a>d
C.c点:c(NH4+)=c(Cl﹣)=1.0molL﹣1
D.25℃时,NH4Cl的水解常数(Kh)=(n﹣1)×10﹣7
【答案】D
【解析】解:A.酸碱中和反应是放热反应,反应过程中会导致溶液温度升高,弱电解质的电离是吸热过程,一水合氨是弱电解质,所以一水合氨电离过程中吸收热量,当温度最高时氨水和盐酸恰好完全反应,二者的物质的量相等,根据图知,二者完全反应时氨水体积小于10mL,则氨水浓度大于1.0mol/L,即n>1.0,故A错误; B.酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中c(H+)或碱中c(OH﹣)越大,其抑制水电离程度越大;
根据图知,a点溶液中没有滴加氨水,溶质为HCl,b点溶液温度最高,说明二者恰好完全反应生成氯化铵,所以溶质为NH4Cl,NH4Cl溶液呈酸性,要使混合溶液呈中性,则氨水应该过量,所以c点溶液中溶质为NH4Cl和NH3 . H2O,d点溶液中溶质为NH4Cl和NH3 . H2O,且c(NH4Cl)<c(NH3 . H2O),
a点、d点抑制水电离,且a点抑制水电离程度大于d;
b、c点促进水电离,但b点促进水电离程度大于c;
所以水电离程度大小顺序是b>c>d>a,
故B错误;
C.c点溶液呈中性,则c(NH4+)=c(Cl﹣),因为溶液体积是盐酸的二倍,所以c(Cl﹣)是原来的一半,为0.5mol/L,故C错误;
D.c点溶液呈中性,c(H+)=c(OH﹣)=10﹣7 mol/L,则c(NH4+)=c(Cl﹣),因为溶液体积是盐酸的二倍,所以c(Cl﹣)是原来的一半,则c点c(NH4+)=c(Cl﹣)=0.5 mol/L,c点溶液中c(NH3 . H2O)=0.5nmol/L﹣0.5mol/L,水解平衡常数Kh= ![]() =
= ![]() =(n﹣1)×10﹣7 , 故D正确;
=(n﹣1)×10﹣7 , 故D正确;
故选D.


科目:高中化学 来源: 题型:
【题目】锎是锕系中的一种元素,1 mg锎(![]() )每秒钟约能释放出2.34×109个中子,在医学上常用作治疗恶性肿瘤的中子源。下列有关说法错误的是 ( )
)每秒钟约能释放出2.34×109个中子,在医学上常用作治疗恶性肿瘤的中子源。下列有关说法错误的是 ( )
A. ![]() 中,质子数和电子数均为98 B.
中,质子数和电子数均为98 B. ![]() 和
和![]() 互为同位素
互为同位素
C. 锎位于元素周期表第六周期 D. ![]() 的中子数与质子数之差为56
的中子数与质子数之差为56
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
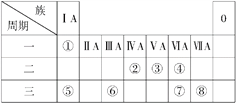
Ⅰ.(1)请画出元素⑧的离子结构示意图: _______________。
(2)⑦和⑧的最高价氧化物对应水化物的酸性强弱为______>______(填化学式)。
(3)④⑤两种元素的原子按1∶1组成的常见化合物的电子式为________。
Ⅱ.常见物质A、B、C均含有表中①~⑧中的一种或几种元素,可发生以下反应(副产物已略去),试回答:
![]()
![]()
![]()
![]()
![]()
(1)若X是强氧化性单质,则A可能是______ (填序号)。
a.S b.Na c.Al d.NH3 e.CH4
(2)若X是一种常见过渡金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀。写出反应②的化学方程式: ____________________。
(3)若A、B、C为含有同一金属元素的化合物,X为强电解质,A溶液与C溶液反应生成B,写出A与C两溶液反应的离子方程式: _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下,它们之间的相互转化关系如图所示(反应中生成的H2O已略去)。

请回答下列问题:
(1)若A是一种常见的强碱,C常用于糕点发酵,则反应①的离子方程 式是__________________。
(2)若A是一种碱性气体,常用作制冷剂,B、D是空气中的主要成分,则C的化学式为_______________。
(3)若A是一种无色、有臭鸡蛋气味的气体,C是导致酸雨的主要气体,则反应③的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硝酸和锌的反应的化学方程式为:Zn + 4HNO3 = Zn(NO3)2 + 2H2O + 2X↑,则X为
A. H2B. NH3C. NOD. NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家经过研究后发现,把水加热加压到 374℃、22.lMPa以上时具有很多特性, 如其中含有的氢离子浓度远远大于10-7mol/L,还具有很强的溶解有机物的能力。由此可知,处于这种状态下的水( )
A.显中性, pH一定等于 7B.表现出非极性溶剂的特性
C.显酸性,pH 一定小于 7D.表现出极性溶剂的特性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com