
短周期原子序数依次递增的A、B、C、D、E、F六种元素,已知B原子最外层电子数是A原子次外层电子数的3倍,是D原子最外层电子数的2倍;C原子内层电子总数是最外层电子数10倍;A、B、D三种元素的原子最外层电子数之和为13;A和B原子最外层电子数之和与D和F原子最外层电子数之和相等;D和E是相邻两种元素。
(1)E元素基态原子的核外电子占用了 个原子轨道 。
(2)A、B、C三种元素组成原子个数比为n(A):n(B):n(C)=1:3:2的化合物,该化合物的水溶液显 (填“酸性”“碱性”“中性”),原因用离子方程式可表示为 。
(3)B、C、D三种元素离子半径最小的是 (填离子符号);AB2 分子的电子式
是 。M元素与D元素位于不同主族,但由于二者的电负性相近,导致某些性
相似,将M的最高价氧化物溶于C的氢氧化物的水溶液中,发生反应的离子方程式为 。
(4)E和F形成的化合物X容易水解生成两种酸,写出该水解反应的化学方程式 。
(1)8 (2)碱性 CO32- +
H2O HCO3- +OH-
HCO3- +OH-
(3)Al3+ ;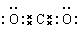 ; BeO + 2OH-=BeO22- + H2O
; BeO + 2OH-=BeO22- + H2O
(4)SiCl4 + 3H2O=4HCl + H2SiO3↓
【解析】
试题分析:C原子内层电子总数是最外层电子数10倍,这说明C一定是钠元素。B原子最外层电子数是A原子次外层电子数的3倍,是D原子最外层电子数的2倍;且AB的原子序数小于钠元素的,所以B应该是氧元素。由于D的原子序数大于钠元素的,所以D是Al元素。A、B、D三种元素的原子最外层电子数之和为13,所以A元素的最外层电子数是4个,即A是碳元素。A和B原子最外层电子数之和与D和F原子最外层电子数之和相等,所以F的最外层电子数是7个,则F是氯元素。D和E是相邻两种元素,其中E的原子序数大于铝的,小于氯元素的,则E是Si元素。
(1)根据构造原理可知,Si元素的核外电子排布是1s22s22p63s23p2,则Si元素基态原子的核外电子占用了8个原子轨道。
(2)A、B、C三种元素组成原子个数比为n(A):n(B):n(C)=1:3:2的化合物,该化合物碳酸钠,溶于水水解显碱性,水解方程式是CO32- + H2O HCO3- +OH-。
HCO3- +OH-。
(3)核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,则B、C、D三种元素离子半径最小的是Al3+;CO2是含有极性键的共价化合物,电子式是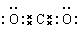 ;M元素与D元素位于不同主族,但二者的电负性相近,所以M是Be元素,氧化铝是两性氧化物,则氧化铍能溶于氢氧化钠溶液中,反应的离子方程式是BeO + 2OH-=BeO22-
+ H2O。
;M元素与D元素位于不同主族,但二者的电负性相近,所以M是Be元素,氧化铝是两性氧化物,则氧化铍能溶于氢氧化钠溶液中,反应的离子方程式是BeO + 2OH-=BeO22-
+ H2O。
(4)根据原子守恒可知,生成的两种酸应该是盐酸和硅酸,反应的化学方程式是SiCl4+3H2O=4HCl+H2SiO3↓。
考点:考查元素周期表第结构和元素周期律的应用以及常见化学用语的书写
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
(12分)A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有5个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A的最高价氧化物对应的水化物是_______(填化学式);
(2)物质E中所包含的化学键有________,写出C、D两元素形成的化合物C2D的电子式_________;
(3)在同主族氢化物的递变性质中,A的氢化物沸点反常,这可以用 解释。
A.共价键 B.离子键 C.氢键 D.范德华力
(4)与C同主族且处于第七周期的元素的原子序数是 .
(5)把盛有48 mL AB、AB2混合气体的容器倒置于水中(同温、同压下),待液面稳定后,容器内气体体积变为24 mL,则原混合气体中AB的体积分数为_______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
Ⅰ.甲、乙、丙、丁、戊具有如图所示的结构或结构单元,图中四面体外可能有的部分未画出,只有实线表示共价键,X、Y可同可不同。
已知:甲、乙晶体类型相同,单质甲能与乙发生置换反应,丙、丁、己三种粒子均含有等量的总电子数,其中丙、己是同一类晶体中的分子,己在常温下呈液态,能产生两种10电子的离子,丁是阳离子且与丙符合“等电子原理”(具有相同电子数和原子数的分子或离子互称为等电子体),戊通常为气体与丙结构相似,但分子中多了24个价电子。
(1)写出液态己产生两种等电子粒子的电离方程式: 。
(2)X、Y原子的最外层都满足8电子的分子是 (填字母代号)
A.甲 B.乙 C.丙 D.戊 E.己
(3)写出甲与乙发生置换反应的反应方程式: 。
(4)丙是目前重要的能源之一。
① 丙和己在催化、加热条件下得到可燃性的两种气体,其反应的化学方程式是: 。
② 现代高能电池中,常用丙作燃料电池的原料,在碱性介质(KOH溶液)的情况下,其正极反应的电极方程式为 。
(5)请写出一种与戊符合“等电子原理”的离子 。
Ⅱ.A 、B 、C 、D 、E 五种短周期元素,原子序数依次增大.A、D同主族,A 与B 、C 分别构成电子数相等的化合物w、k,且w是一种能产生温室效应的气体;D 元素最外层电子数是次外层电子数的3 倍;A 、B 、C 、D 可形成化合物x;A 、D 、E 可形成化合物y;A 、C 、D 可形成化合物z.x、y、z 均为阳离子和阴离子个数比是1 : 1 的离子化合物.回答下列问题:
(1)y的电子式为_________________;w属于______ (填“极性”或“非极性)分子;
(2)与E 同主族且为第七周期的元素原子序数为_________________;
(3)在同主族氢化物的性质递变中,k 的沸点反常,这可以用__________来解释(填字母序号);
A.共价健 B.离子键 C.氢键 D.范德瓦耳斯力
(4)常温下,x 与y以物质的量之比1 : 2 反应后所得溶液显_______(填“酸”、“碱”或“中”)性,由产物分析,原因是________________________(用离子方程式表示);
(5)由k与D 的单质、KOH 溶液构成原电池,负极会产生C 的单质。则其负极反应为______________________________;一段时间后,溶液pH__________(填“增大”、“减小”或“不变” )。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省温州中学高一下学期期中考试理科化学试卷(带解析) 题型:填空题
(12分)A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有5个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A的最高价氧化物对应的水化物是_______(填化学式);
(2)物质E中所包含的化学键有________,写出C、D两元素形成的化合物C2D的电子式_________;
(3)在同主族氢化物的递变性质中,A的氢化物沸点反常,这可以用 解释。
A.共价键 B.离子键 C.氢键 D.范德华力
(4)与C同主族且处于第七周期的元素的原子序数是 .
(5)把盛有48 mL AB、AB2混合气体的容器倒置于水中(同温、同压下),待液面稳定后,容器内气体体积变为24 mL,则原混合气体中AB的体积分数为_______ 。
查看答案和解析>>
科目:高中化学 来源:2014届浙江省高一下学期期中考试文科化学试卷(解析版) 题型:填空题
(10分)A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有5个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A的最高价氧化物对应的水化物是_______(填化学式);
(2)物质E中所包含的化学键有________,写出C、D两元素形成的化合物C2D的电子式_________;
(3)在同主族氢化物的递变性质中,A的氢化物沸点反常,这可以用 解释。
A.共价键 B.离子键 C.氢键 D.范德华力
(4)与C同主族且处于第七周期的元素的原子序数是 .
查看答案和解析>>
科目:高中化学 来源:2014届江苏省淮安市高一下学期第一次过关练习化学试卷 题型:填空题
(8分)A、B、C、D、E五种短周期元素,原子序数依次增大。A与B、C分别构成电子数相等的化合物W、K,且W是一种能产生温室效应的气体;D元素最外层电子数是次外层电子数的3倍。A、D、E构成化合物Y,A、B、C、D构成化合物X,且X、Y均为阳离子和阴离子个数比是1∶1的离子化合物。
回答下列问题:
(1)Y的电子式为________;W形成________晶体。
(2)与E同主族且为第7周期的元素原子序数为________。
(3)在同主族氢化物的递变性质中,K的沸点反常,这可以用________来解释(填字母序号)。
A.共价键 B.离子键
C.氢键 D.范德华力
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com