
| A、含NA个氧分子的氧气的体积等于22.4L |
| B、Na2O2与H2O反应制O2,每生成1 mol O2转移4NA个电子 |
| C、1mol CH3OH在燃料电池负极发生反应时得到4NA个电子 |
| D、O.O1mol Mg在空气中完全燃烧,生成MgO和Mg3N2,转移电子数是0.02NA |


科目:高中化学 来源: 题型:
| A、五种元素中原子半径最大的是E,最小的是A |
| B、A和B、D、E均能形成共价型化合物中,稳定性最差的是A、D形成的化合物 |
| C、E最高价氧化物对应水化物化学式为H2EO4 |
| D、C的单质在空气中燃烧产物的化学式为C2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
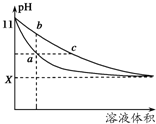 某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )| A、a点导电能力比b点强 |
| B、对于b、c两点,Kb>Kc |
| C、与盐酸完全反应时,消耗盐酸体积Va>Vc |
| D、X的值接近7,但大于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
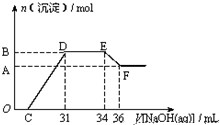 某同学取一定量Fe与Al的混合物与一定量极稀的硝酸充分反应,已知硝酸的还原产物仅有一种,在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示,试分析硝酸被还原后生成的产物为( )
某同学取一定量Fe与Al的混合物与一定量极稀的硝酸充分反应,已知硝酸的还原产物仅有一种,在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示,试分析硝酸被还原后生成的产物为( )| A、NH4NO3 |
| B、NO2 |
| C、NO |
| D、N2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) |
| B、pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) |
| C、常温下,等物质的量浓度的三种溶液①(NH4)2SO4 ②NH4Cl③(NH4)2Fe(SO4)2中c(NH4+):②<①<③ |
| D、0.1mol?L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,11.2 L氯气所含原子数目为NA |
| B、2 L 0.2 mol/L的K2SO4溶液中K+数目为0.8NA |
| C、1 mol Fe作还原剂可提供电子数为2NA |
| D、标准状况下,NA个CO2分子和NA个H2O分子的体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
| 1 | 20.00 | 11.95 |
| 2 | 20.00 | 13.00 |
| 3 | 20.00 | 12.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(H2O) |
| n(CH4) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、实验Ⅰ:配置一定物质的量浓度的溶液 |
| B、实验Ⅱ:除去Cl2中的HCl |
| C、实验Ⅲ:用水吸收NH3 |
| D、实验Ⅳ:石油的分馏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com