
【题目】天然气和可燃冰(mCH4·nH2O)既是高效洁净的能源,也是重要的化工原料。
(1)可燃冰(mCH4·nH2O)属于 晶体。
(2)已知25 ℃、101 kPa 时,1 g甲烷完全燃烧生成液态水放出55.64 kJ热量,则该条件下反应CH4(g)+2O2 (g)=CO2 (g)+2H2O (l)的ΔH=
(3)用甲烷空气碱性(KOH溶液)燃料电池作电源,电解CuCl2溶液。装置如图所示:
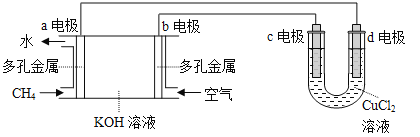
①a电极名称为 。
②c电极的电极反应式为 。
③假设CuCl2溶液足量,当某电极上析出3.2 g 金属Cu时,理论上燃料电池消耗的空气在标准状况下的体积是 L(空气中O2体积分数约为20%)。
【答案】(1)分子(1分)(2)-890.24 kJ/mol (3)①负极(1分) ②2Cl--2e- = Cl2↑ ③2.8
【解析】
试题分析:(1)可燃冰的熔沸点较低,属于分子晶体。
(2)1 g甲烷完全燃烧生成液态水放出55.64 kJ热量,则1mol甲烷完全燃烧生成液态水放出热量为55.64kJ×16=890.24,则该条件下反应的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)的ΔH=-890.24kJ/mol。
(3)①甲烷、空气燃料电池中,甲烷在负极失电子发生氧化反应,则a电极是负极,氧气在正极得电子发生还原反应,b电极是正极;
②根据上述分析,b电极是正极,则c电极与电源的正极相连,c电极是阳极,溶液中的氯离子在阳极放电生成氯气,电极反应为2Cl--2e-=Cl2↑;
③根据电极反应,阴极:Cu2++2e-=Cu,正极:O2+4e-+2H2O=4OH-,因为各个电极放电量相等,则Cu与氧气的关系式为2Cu~O2,3.2g铜的物质的量为0.05mol,则需要氧气0.025mol,空气中O2体积分数约为20%,所以通入空气的体积为0.025mol×5×22.4L/mol=2.8L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】日常生活中硫、氮氧化物的排放可能导致“酸雨”。下列活动会导致“酸雨”危害加剧的是( )
A.种草植树,建设“海绵”城市 B.推广使用电动车
C.普及燃煤供暖,减少石油依赖 D.开发太阳能照明
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮的固定具有重要意义。
(1)雷雨天气中发生自然固氮后,氮元素转化为 而存在于土壤中.处于研究阶段的化学固氮新方法是N2在催化剂表面与水发生如下反应:
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H K ①
已知:N2(g)+3H2(g)=2NH3(g)△H1=﹣92.4kJmol﹣1 K1 ②
2H2(g)+O2(g)=2H2O(l)△H2=﹣571.6kJmol﹣1 K2 ③
则△H= ;K= (用K1和 K2表示)。
(2)在四个容积为2L的密闭容器中,分别充入1mol N2、3mol H2O,在催化剂条件下进行反应①3小时,实验数据见下表:
序号 | 第一组 | 第二组 | 第三组 | 第四组 | ||||||||||
t/℃ | 30 | 40 | 50 | 80 | ||||||||||
NH3生成量/(10﹣6mol) | 4.8 | 5.9 | 6.0 | 2.0 | ||||||||||
下列能说明反应①达到平衡状态的是 (填字母)。K]
a.NH3和O2的物质的量之比为4:3
b.反应混合物中各组份的质量分数不变
c.单位时间内每消耗1molN2的同时生成2molNH3
d.容器内气体密度不变
若第三组反应3h后已达平衡,第三组N2的转化率为 ;与前三组相比,第四组反应中NH3生成量最小的原因可能是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应aA(g)+bB(g)![]() cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
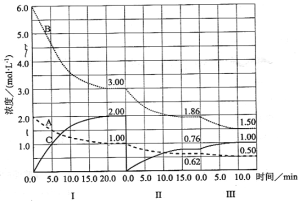
回答问题:
(1)反应的化学方程式中a∶b∶c为 ;
(2)由第一次平衡到第二次平衡,平衡移动的方向是_____,采取的措施是____________。
(3)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低;T2 T3(填“<”“>”“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在生产、生活和科技等方面都有着重要的应用。回答下列问题:
(1)碘不宜溶于水,但易溶于碘化钾溶液并生成多碘离子,反应如下:
①I2(s)+I-(aq)![]() I3-(aq) △H<0;②I2(s)+2I-(aq)
I3-(aq) △H<0;②I2(s)+2I-(aq)![]() I42-(aq)。反应②的平衡常数的表达式为K=___________。温度升高时,反应①的平衡常数将____________(填“增大”“减小”或“不变”)
I42-(aq)。反应②的平衡常数的表达式为K=___________。温度升高时,反应①的平衡常数将____________(填“增大”“减小”或“不变”)
(2)碘与钨在一定温度下,可发生如下可逆反应:W(s)+I2(g)![]() WI2(g)。现准确称取0.508g碘和0.736g金属钨放置于50.0mL的密闭容器中,并加热使其反应。如图是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
WI2(g)。现准确称取0.508g碘和0.736g金属钨放置于50.0mL的密闭容器中,并加热使其反应。如图是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
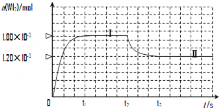
①该反应△H__________0(填“>”或“<”)。
②反应从开始到t1(t1= 3 min)时间内的平均速率v(I2)= 。
③在450℃时,该反应的平衡常数K=______________。
④能够说明上述反应已经达到平衡状态的有 (填选项字母)。
A.I2与WI2的浓度相等
B.单位时间内,金属钨消耗的物质的量与单质碘生成的物质的量相等
C.容器内混合气体的密度不再改变
D.容器内气体压强不发生变化
(3)I2O5是白色粉末状固体,可用作氧化剂使H2S、CO、HC1等氧化,在合成氨工业中常用I2O5来定量测量CO的含量。已知:①2I2(s)+5O2(g)=2I2O5(s) ΔH=-75.56kJmol-1②2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJmol-1 。写出CO(g)与I2O5(s)反应析出固态I2的热化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸苯乙酯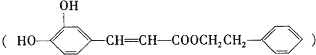 是一种天然抗癌药物,在一定条件下能发生如下转化
是一种天然抗癌药物,在一定条件下能发生如下转化
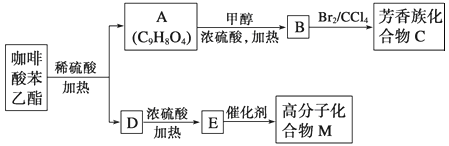
请回答下列问题:
(1)D分子中的官能团是__________;
(2)高分子化合物M的结构简式是__________;
(3)写出A→B反应的化学方程式:__________;
(4)B→C的反应类型为__________;
(5)1molA最多可消耗__________molNaOH;
(6)一定条件下1molA最多与__________mol氢气加成
(7)A的同分异构体有很多种,其中,同时符合下列条件的同分异构体的结构简式:__________
①苯环上只有两个取代基 ②能发生银镜反应 ③能与碳酸氢钠溶液反应 ④能与氯化铁溶液发生显色反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com