
【题目】已知氢气在氯气中燃烧时产生苍白色火焰,在反应过程中,破坏1 mol氢气的化学键消耗的能量为Q1 kJ,破坏1 mol氯气的化学键消耗的能量为Q2kJ ,形成1 mol氯化氢的化学键释放的能量为Q3kJ,下列关系式正确的是
A. Q1 + Q2 > Q3 B. Q1 + Q2 < Q3 C. Q1 + Q2 > 2Q3 D. Q1 + Q2 < 2Q3
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:2Fe2++Br2===2Fe3++2Br-,2Br-+Cl2===Br2+2Cl- , 2Fe3++2I-===2Fe2++I2。向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如下图所示。下列有关说法中,不正确的是
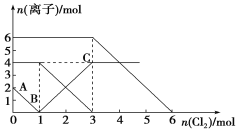
A. 还原性:I->Fe2+>Br-
B. 当通入2 molCl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
C. 原溶液中n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3
D. 原混合溶液中FeBr2的物质的量为6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—液态多硫电池具有能量密度高、储能成本低等优点,以熔融金属锂、熔融硫和多硫化锂[Li2Sx(2≤x≤8)]分别作两个电极的反应物,固体Al2O3陶瓷(可传导Li+)为电解质,其反应原理如图所示。下列说法错误的是
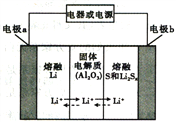
A. 该电池比钠一液态多硫电池的比能量高
B. 放电时,内电路中Li+的移动方向为从a到b
C. Al2O3的作用是导电、隔离电极反应物
D. 充电时,外电路中通过0.2mol电子,阳极区单质硫的质量增加3.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G七种元素的原子序数依次递增,前四种元素为短周期元素![]() 位于元素周期表s区,电子层数与未成对电子数相等;B基态原子中电子占据三种能量不同的原子轨道,且每轨道中的电子总数相同;D原子核外成对电子数为未成对电子数的3倍;F位于第四周期d区,最高能级的原子轨道内只有2个未成对电子;E的一种氧化物具有磁性;C与G同主族。
位于元素周期表s区,电子层数与未成对电子数相等;B基态原子中电子占据三种能量不同的原子轨道,且每轨道中的电子总数相同;D原子核外成对电子数为未成对电子数的3倍;F位于第四周期d区,最高能级的原子轨道内只有2个未成对电子;E的一种氧化物具有磁性;C与G同主族。
(1)![]() 基态原子的价电子轨道排图为______,B2A2的电子式为_______,CD3-的空间构型为______ .
基态原子的价电子轨道排图为______,B2A2的电子式为_______,CD3-的空间构型为______ .
(2)F(BD)n的中心原子价电子数与配体提供电子总数之和为18(1个BD分子可提供的电子数为2),则![]() ______
______ ![]() 根据等电子原理,B、D分子内
根据等电子原理,B、D分子内![]() 键与
键与![]() 键的个数之比为______ .
键的个数之比为______ .
(3)FXO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为![]() ,若晶体中的F分别为F2+、F3+,此晶体中F2+与F3+的最简整数比为______ .
,若晶体中的F分别为F2+、F3+,此晶体中F2+与F3+的最简整数比为______ .
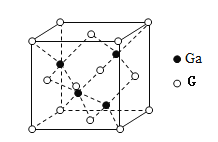
(4)G元素与Ga可形成原子晶体GaG,其晶胞结构如图所示,密度为![]() ,Ga和G的摩尔质量分别为M1g·mol-1和M2g·mol-1原子半径分别为r1pm和r2pm,阿伏伽德罗常数值为
,Ga和G的摩尔质量分别为M1g·mol-1和M2g·mol-1原子半径分别为r1pm和r2pm,阿伏伽德罗常数值为![]() ,则该晶胞中原子的体积占晶胞体积的百分率为______.(写出用M1、和M2、r1、r2、ρ表示的计算式)
,则该晶胞中原子的体积占晶胞体积的百分率为______.(写出用M1、和M2、r1、r2、ρ表示的计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种物质随着X的变化,Y发生相应的变化,其变化关系如图所示。
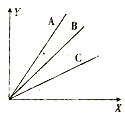
(1)若X表示的是物质的量,则Y表示的不可能是_____(填序号,下同)
①物质的量 ②物质的体积 ③物质所含分子或原子的数目 ④物质的摩尔质量
(2)若A、B、C均为气体且压强恒定时,X表示的是温度,则Y表示的可能是______。
①气体的质量 ②气体的分子数 ③气体的体积 ④气体的摩尔质量
(3)若A、B、C均为气体,Y表示在相同条件下气体的体积,X表示的是气体的质量。
①相同条件下A、B、C三种气体的密度由大到小的顺序是_____(用字母A、B、C表示,下同)。
②A、B、C三种气体的摩尔质量由大到小的顺序是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以将反应E+B2+=E2++B设计成原电池,下列4个电极反应: ①B﹣2e﹣=B2+
②E﹣2e﹣=E2+
③B2++2e﹣=B
④E2++2e﹣=E
其中表示负极反应和正极反应的分别是( )
A.②和③
B.②和①
C.③和①
D.④和①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N4分子结构为正四面体(如图所示)。已知:断裂N4(g)中1 molN-N键吸收193kJ能量,形成N2(g)中1 mol N![]() N放出941 kJ能量。下列说法正确的是
N放出941 kJ能量。下列说法正确的是
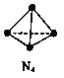
A. N4(g)比N2(g)更稳定
B. N4(g)=2N2(g) △H=+724kJmol-1
C. 形成1 mol N4(g)中的化学键放出193 kJ的能量
D. lmolN2(g)完全转化为N4(g),体系的能量增加362kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化锶(SrO2·2H2O)晶体是一种白色粉末,微溶于水,常用作焰火的引火剂。制备流程如下:
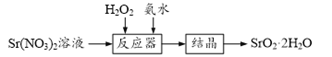
反应原理:Sr(NO3)2+H2O2+2NH3·H2O=SrO2·2H2O↓+2NH4NO3,该反应放热。
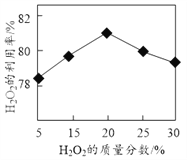
(1)选择不同浓度的双氧水在反应器中反应,测得相同时间H2O2的利用率随浓度的变化关系如图所示。5%的H2O2比20%的H2O2的利用率低的原因是______。
(2)SrO2·2H2O与CO2会反应变质,反应的化学方程式为______。
(3)25℃时,将Sr(NO3)2溶液滴加到含有F-、CO32-的溶液中,当c(Sr2+)=0.0010 mol·L-1时,同时存在SrF2、SrCO3两种沉淀,则此时溶液中c(F-):c(CO32-)=______。[已知25℃时:Ksp(SrF2)=4.0×10-9,Ksp(SrCO3)=5.0×10-9]
(4)准确称取1.8000 g SrO2·2H2O样品置于锥形瓶中,加入适量的盐酸使之充分转化为H2O2,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用1.0000 mol·L-1 Na2S2O3标准液滴定到蓝色恰好消失时,共消耗标准液20.00 mL,计算SrO2·2H2O样品的纯度,写出计算过程________。(已知:S2O32-![]() S4O62-)
S4O62-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算
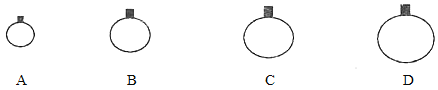
(1)常温常压下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出四个气球,其中气体为SO2的是_____(填选项序号)。
(2)在标准状况下,2.24L由N2、N2O组成的混合气体中含有的氮元素的质量约为_______。
(3)在0.1L由KCl、K2SO4、ZnSO4形成的某植物营养液中,c(K+)=0.7 mol·L1,c(Zn2+)=0.1 mol·L1,c(Cl)=0.3mol·L1,向混合溶液中滴加足量的BaCl2溶液后产生沉淀的物质的量为_______。
(4)氯气(Cl2)、重铬酸钾(K2Cr2O7)是常用的氧化剂。
①硫代硫酸钠(Na2S2O3)被称为“养鱼宝”,可降低水中的氯气对鱼的危害。已知25.0mL0.100 mol·L1 Na2S2O3溶液恰好把标准状况下224mL的Cl2完全转化为Cl,则S2O32将转化成______。
A.S2 B.S C.SO32 D.SO42
②实验室可用K2Cr2O7固体与浓盐酸反应制备氯气,发生反应的化学方程式为K2Cr2O7 + 14HCl(浓)=3Cl2↑ + 2CrCl3 +2KCl +7H2O,若反应中转移0.6mole,则被氧化的HCl的物质的量为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com