
要使含有Ag+、Cu2+、Mg2+、Ba2+等离子的溶液中的离子逐一形成沉淀析出,下列所选择试剂及加入试剂的顺序正确的是
A.H2SO4→HCl→K2S→NaOH→CO2 B.Na2SO4→NaCl→Na2S→NH3·H2O
C.NaCl→Na2SO4→H2S→NaOH D.Na2S→Na2SO4→NaCl→NaOH
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
具有相同电子层结构的三种粒子A2+、B2-、C-.下列分析正确的是
A.原子序数关系是A>C>B B.离子半径关系是B2-<A2+
C . C一定是稀有气体元素的一种原子 D.原子半径关系是A<C<B
查看答案和解析>>
科目:高中化学 来源: 题型:
已知FeS与某浓度的HNO3反应时生成Fe(NO3)3、H2SO4和某种单一的还原产物,若FeS和参与反应的HNO3的物质的量之比为1︰6,则该反应的还原产物是
A.NO2 B.NH4NO3 C.N2O D.NO
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子,一定能在指定环境中大量共存的是
A.在含有大量I-离子的溶液中:Cl¯、Fe3+、Al3+、Cu2+
B.滴加石蕊试液显红色的溶液:Fe2+、NH4+、Cl-、NO3-能够大量共存
C.在由水电离出的c(H+)=10-12 mol·L-1的溶液中:Na+、Ba2+、Cl¯、Br¯
D.在加入Al能放出大量H2的溶液中:NH4+、SO42¯ 、C1¯、HCO3¯
查看答案和解析>>
科目:高中化学 来源: 题型:
NA为阿伏加德罗常数,下列说法正确的是
A.标准状况下,11.2L的戊烷所含的分子数为0.5NA
B.28g乙烯所含共用电子对数目为4NA
C.1mol 苯中含有碳碳双键的数目为3 NA
D.2.8g聚乙烯中含有的碳原子数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
有一瓶澄清的溶液,其中可能含NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cl-、I-、NO3-、CO32-、SO42-,取该溶液进行以下实验:
(1)取pH试纸检验,表现溶液呈强酸性,排除__________离子存在。
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4层呈紫红色,排除____离子的存在。
(3)另取部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生,则可排除__________离子的存在。
取部分碱性溶液加热有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
(4)另取部分上述碱性溶液加Na2CO3溶液,有白色沉淀生成,证明__________离子存在,又排除__________离子存在。
(5)根据上述实验事实确定,该溶液中肯定存在的离子是__________;肯定不存在的离子是__________;还不能确定是否存在的离子是________________,要确定其中的阳离子可利用的原理是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.某物质经科学测定只含有一种元素,则可以断定该物质是一种纯净物
B.不能用瓷坩埚加热熔融氢氧化钠固体
C.将SO2通入品红溶液或溴水均能使它们褪色,证明SO2有漂白性
D.向某溶液中滴加氯水后,滴加KSCN溶液,溶液变红,证明溶液中含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
“化学是一门中心学科,与社会、生活、科研密切的关系”。下列叙述中,不正确的是
A.大量使用燃煤发电是形成雾霾的主要原因
B.天然气、煤气大量泄漏遇到明火会爆炸
C.利用化学反应可实现12C到14C的转化
D.晶体硅可用于光伏发电、制造芯片
查看答案和解析>>
科目:高中化学 来源: 题型:
食盐是日常生活的必需品,也是重要的化工原料.
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42﹣等杂质离子,实验室提纯NaCl的流程如图甲:
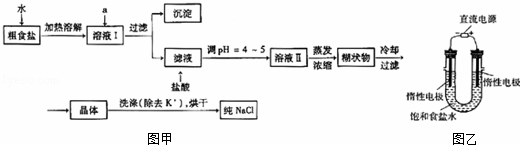
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液Ba(NO3)2溶液、75%乙醇、四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42﹣离子,选出a所代表的试剂,按滴加顺序依次为 BaCl2、NaOH、Na2CO3 (只填化学式).
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为 75%乙醇
(2)用提纯的NaCl配制500mL 4.00mol•L﹣1 NaCl溶液,所用仪器除药匙、玻璃棒外还有 天平、烧杯、500mL容量瓶、胶头滴管 (填仪器名称).
(3)电解饱和食盐水的装置如图乙所示,若收集的H2为2L,则同样条件下收集的Cl2 < (填“>”、“=”或“<”)2L,原因是 电解生成的氯气与电解生成的NaOH发生了反应 .装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法是 中和滴定 .
(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4═ZnSO4+H2↑;MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置 e (填代号)和制备并收集干燥、纯净Cl2的装置 d (填代号).可选用制备气体的装置:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com