
NA为阿伏加德罗常数,下列说法正确的是
A.标准状况下,11.2L的戊烷所含的分子数为0.5NA
B.28g乙烯所含共用电子对数目为4NA
C.1mol 苯中含有碳碳双键的数目为3 NA
D.2.8g聚乙烯中含有的碳原子数为0.2 NA
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
同主族元素形成的同一类型化合物,往往其结构和性质相似。PH4I是一种白色晶体,下列对PH4I的叙述中,不正确的是
A.它是一种共价化合物 B.它既含离子键又含共价键
C.它可能与NaOH溶液反应 D.它受热时,可能会分解产生有色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列鉴别方法可行的是
A.用氨水鉴别Al3+、Mg2+和Ag+
B.用Ba(NO3)2溶液鉴别Cl-、SO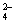 和CO
和CO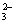
C.用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷
D.用KMnO4酸性溶液鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
铁是一种应用广泛的金属。下列有关铁的说法正确的是
A.铁与盐酸反应生成氯化铁和氢气 B.常温下铁在浓硫酸中钝化
C.铁在氧气中燃烧生成物为三氧化二铁 D.纯铁(块状)是黑色金属
查看答案和解析>>
科目:高中化学 来源: 题型:
要使含有Ag+、Cu2+、Mg2+、Ba2+等离子的溶液中的离子逐一形成沉淀析出,下列所选择试剂及加入试剂的顺序正确的是
A.H2SO4→HCl→K2S→NaOH→CO2 B.Na2SO4→NaCl→Na2S→NH3·H2O
C.NaCl→Na2SO4→H2S→NaOH D.Na2S→Na2SO4→NaCl→NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
图中各物质是中学化学中常见的物质,甲、乙均是离子化合物,且阴、阳离子个数比为1∶1。甲是发酵粉的主要成分,乙是一种常用的化肥,B、D常温常压下是气体。请回答下列问题:
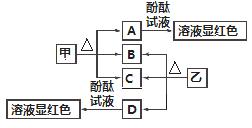
(1)甲的俗名是________。
(2)A、D物质的水溶液分别滴入酚酞试液后,溶液均显红色,其原理________(填“相同”或“不相同”)。
(3)甲在潮湿的空气中会缓慢分解,A会吸收空气中的水分:A+nH2O===A·nH2O(n为平均值,n≤10),取没有妥善保管的甲样品9.16 g,溶于水制成溶液,慢慢滴入稀盐酸并不停地搅拌,加入盐酸的体积与生成的B的体积(标准状况)如下表:(溶于水中的B不计)
| 盐酸的体积(mL) | 4 | 8 | 15 | 20 | 50 | 120 | 150 |
| 生成B的体积(mL) | 0 | 0 | 112 | 224 | 896 | 2240 | 2240 |
则:
① 稀盐酸的物质的量浓度为__________________________________。
② 样品中的成分及其物质的量分别为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
I、煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+7O2+2H2O 4H++2Fe2++4SO42- ;
4H++2Fe2++4SO42- ;
②Fe2++O2+H+ Fe3++____________;
Fe3++____________; 
③FeS2+2Fe3+ 3Fe2++2S;
3Fe2++2S;
④2S+3O2+2H2O 4H++2SO42-。
4H++2SO42-。
已知:FeS2中的硫元素为-1价。
回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述②离子方程式配平并补充完整。
(2)反应③的还原剂是 。
(3)观察上述反应,硫元素最终转化为 从煤炭中分离出来。
II、工业上用黄铜矿( CuFeS2)冶炼铜,副产品中也有SO2 ,冶炼铜的反应为
8CuFeS2 + 21O2 8Cu + 4FeO + 2Fe2O3 + 16SO2
8Cu + 4FeO + 2Fe2O3 + 16SO2
若CuFeS2中 Fe 的化合价为+2 ,反应中被还原的元素是 (填元素符号)。当生成0.8 mol铜时,此反应转移的电子数目是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将碳棒和铁棒平行插入NaCl溶液,两棒的液面以上部分用铜丝相联并接入电流计,电流计指针偏转.以下说法正确的是( )
|
| A. | 电子自碳棒通过溶液流向铁棒 | B. | 电子自铁棒通过铜丝流向碳棒 |
|
| C. | 溶液中的H+得到电子放出H2 | D. | 铜丝失去电子发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com