
| A. | 乙烯使溴水或酸性高锰酸钾溶液褪色均属于加成反应 | |
| B. | 常温常压下环癸五烯 是一种易溶于水的无色气体 是一种易溶于水的无色气体 | |
| C. | 用酸性重铬酸钾溶液检验酒驾,发生的反应属于乙醇的氧化反应 | |
| D. | 等质量的乙烯和乙醇完全燃烧,消耗O2的物质的量相同 |
分析 A、乙烯使高锰酸钾溶液褪色,发生的是氧化反应;
B、有机物多数难溶于水,且此分子相对分子质量较大,常温下为液体;
C、乙醇具有还原性,能被重铬酸钾氧化;
D、物质的量相同的乙烯和乙醇完全燃烧时,消耗氧气的量相同.
解答 解:A、乙烯使高锰酸钾溶液褪色,是利用的高锰酸钾的氧化性,发生的是氧化反应,故A错误;
B、环癸五烯不含亲水基,所以常温常压下环癸五烯是一种不易溶于水的无色液体,故B错误;
C、乙醇被重铬酸钾溶液氧化生成乙酸,所以该反应属于氧化反应,故C正确;
D、乙醇可拆写成C2H4•H2O的形式,物质的量相同的C2H4和C2H4•H2O完全燃烧时,消耗氧气的量相同,等质量的乙醇与乙烯物质的量不同,故耗氧量不同,故D错误,故选C.
点评 本题主要考查的是常见有机化合物的性质,涉及部分烯烃的物理性质以及燃烧规律的应用,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
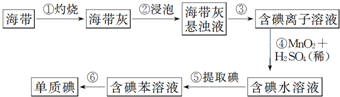
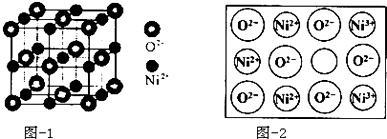
| A. | 步骤①需要用到蒸发皿 | B. | 步骤③需要过滤装置 | ||
| C. | 步骤⑤需要用到分液漏斗 | D. | 步骤⑥需要蒸馏装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上研究利用CO2来生产甲醇燃料的方法,该方法的热化学方程式是:
工业上研究利用CO2来生产甲醇燃料的方法,该方法的热化学方程式是:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol的白磷(P4)或甲烷中所含的共价键数均为0.4NA | |
| B. | 标准状况下,一定量的铜与硝酸反应后生成22.4 L NO、NO2、N2O4的混合气体,则被还原的硝酸的分子数大于NA | |
| C. | 铁做电极电解食盐水,若阴极得到NA个电子,则阳极产生11.2L气体(标准状况下) | |
| D. | 标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
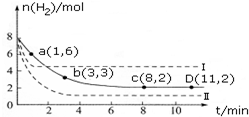
 常温下,在20.00mL 0.100 0mol•L-1 NH3•H2O溶液中逐滴滴加0.1000mol•L-1 HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如右图所示.下列说法正确的是( )
常温下,在20.00mL 0.100 0mol•L-1 NH3•H2O溶液中逐滴滴加0.1000mol•L-1 HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如右图所示.下列说法正确的是( )| A. | ①溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | ②溶液:c(NH4+)=c(Cl-)>c(OH-)=c(H+) | |
| C. | ①、②、③三点所示的溶液中水的电离程度②>③>① | |
| D. | 滴定过程中不可能出现:c(NH3•H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
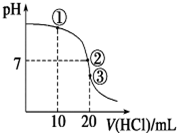
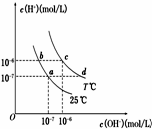 在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )| A. | a点对应的溶液中大量存在:Fe3+、Ba2+、K+、NO3- | |
| B. | b点对应的溶液中大量存在:Na+、K+、NH4+、Cl- | |
| C. | d点对应的溶液中大量存在:Na+、Ba2+、Cl-、Al3+ | |
| D. | c点对应的溶液中大量存在:CO32-、Na+、Cu2+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,C为HOOC-COOH.A的红外光谱图和核磁共振氢谱图如图1:
,C为HOOC-COOH.A的红外光谱图和核磁共振氢谱图如图1:



 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com