
从海带中提取碘单质,成熟的工艺流程如下,下列关于海水制碘的说法,正确的是( )

A.实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌
B.含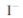 的滤液中加入稀硫酸和双氧水后,碘元素发生还原反应
的滤液中加入稀硫酸和双氧水后,碘元素发生还原反应
C.若在含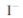 的滤液中加入几滴淀粉溶液,溶液变蓝色
的滤液中加入几滴淀粉溶液,溶液变蓝色
D.碘水中加入CCl4得到I2的CCl4溶液,该操作为“萃取”
科目:高中化学 来源:2015-2016学年山西省高二下学期期末化学试卷(解析版) 题型:选择题
用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨)。下列有关叙述不正确的是( )

A.图中a极连接电源的负极
B.A口放出的物质是氢气,C口放出的物质是氧气
C.b极电极反应式为:SO32--2e-+H2O===SO42-+2H+
D.电解过程中阴极区碱性明显增强
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下学期期末化学B卷(解析版) 题型:选择题
把100mL 2mol/L的H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应速率而不影响生成H2的总量,可在反应物中加入适量的( )
A.硫酸铜溶液 B.硝酸钠溶液 C.醋酸钠溶液 D.氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下学期期未化学试卷(解析版) 题型:填空题
目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。
CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。

(1)该反应为 热反应,原因是 。
(2)下列能说明该反应已经达到平衡状态的是 (填序号)
A.v(H2)=3v(CO2)
B.容器内气体压强保持不变
C.v逆(CO2)=v正(CH3OH)
D.容器内气体密度保持不变
(3)在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)= 。 达平衡时容器内平衡时与起始时的压强之比 。
(4)甲醇、氧气在酸性条件下可构成燃料电池,其负极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下学期期未化学试卷(解析版) 题型:选择题
钓鱼岛及其附属岛屿是中国的固有领土,我国历来十分重视海水资源的综合利用,下列有关海水综合利用的说法正确的是:
A.利用潮汐发电是将化学能转化为电能
B.海水蒸发制海盐的过程中发生了化学变化
C.海水中含有溴元素,只需经过物理变化就可以得到溴单质
D.从海水中可以得到MgCl2,电解熔融MgCl2可制备Mg
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下学期期未化学试卷(解析版) 题型:选择题
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
A.羟基的电子式为: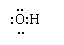
B.HClO的结构式:H—Cl—O
C.丙烷分子的比例模型:
D. S2-的结构示意图:
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省肇庆市高一下学期期末化学试卷(解析版) 题型:选择题
下图为铜锌原电池示意图,下列说法正确的是( )
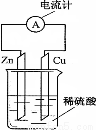
A.锌片逐渐溶解
B.电子由铜片通过导线流向锌片
C.烧杯中溶液逐渐呈蓝色
D.该装置能将电能转变为化学能
查看答案和解析>>
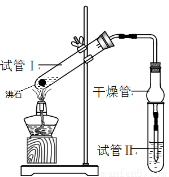
科目:高中化学 来源:2015-2016学年广东省高二下学期期末理科化学试卷(解析版) 题型:实验题
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。某学生在实验室利用下图的实验装置制备乙酸乙酯并研究其反应条件。
物质 | 沸点/?C | 密度/g?cm?3 |
乙醇 | 78.0 | 0.79 |
乙酸 | 117.9 | 1.05 |
乙酸乙酯 | 77.5 | 0.90 |
异戊醇 | 131 | 0.8123 |
乙酸异戊酯 | 142 | 0.8670 |
实验步骤如下:
① 配制反应混合液:2mL浓H2SO4、3mL乙醇、2mL乙酸
② 按图连接实验装置并检验气密性
③ 分别在试管1、试管2中加入反应液
④ 用酒精灯微热3min,再加热使之微微沸腾3min
⑤ 分离提纯乙酸乙酯
(1)在试管1中加入物质分别是:______________(按着加入的先后顺序写出名称),乙醇过量的目的是:_______________;
(2)该反应的平衡常数表达式K=______________;
(3)试管Ⅱ中所盛试剂为___________,欲将其物质分离使用的仪器为___________,在充分振荡的过程中,发生的反应为________________;
(4)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用右图所示装置进行了以下四个实验,实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中的试剂 | 测得有机层的厚度/cm |
A | 2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 5.0 |
B | 3mL乙醇、2mL乙酸 | 0.1 |
C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 |
D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是_________mL和_________mol/L;
②分析实验________(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是____________;
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是_______________;
(5)若利用该装置制备乙酸异戊酯,产物将主要在装置中_______的得到,那么产率会_____(“较高”或“偏低”);
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com