
【题目】氮族元素化合物在医药、纳米材料制备中应用广泛。
(1)P元素的基态电子电子排布式为
(2)白磷的分子式为P4,其结构如下图所示,科学家目前合成了 N4分子, N 原子的杂化轨道类型是 ,N—N—N 键的键角为 ;

(3)N、P、As原子的第一电离能由大到小的顺序为 。
(4)HNO3、HNO2是氮元素形成的含氧酸,酸性较强的是 ,酸根中没有孤对电子的是 ,NO2—价电子构型是 。
(5)立方氮化硼晶体的结构如下图所示:N与As是同族元素,B与Ga是同族元素,立方砷化镓晶体与立方氮化硼晶体结构类似,两种晶体中熔点较高的是 ;立方砷化镓晶体的晶胞边长为a pm,则其密度为 g·cm-3 (用含a的式子表示,设NA为阿伏加德罗常数的值)。

【答案】
(1)1s22s22p63s23p3
(2)sp3 ;60°
(3)N>P>As
(4)HNO3;NO3— ;平面三角型
(5)氮化硼;![]() ;
;
【解析】
试题分析:(1)P元素的基态电子电子排布式为1s22s22p63s23p3,故答案为:1s22s22p63s23p3;
(2)N4分子与P4结构相似,为正四面体构型,N4分子中N原子形成3个σ键、含有1对孤对电子,杂化轨道数目为4,N原子采取sp3杂化,每个面为正三角形,N-N 键的键角为60°,故答案为:sp3;60°;
(3)同主族自上而下第一电离能减小,故第一电离能:N>P>As,故答案为:N>P>As;
(4)HNO3比HNO2中N元素为+3价,HNO3中N原子为+5价,HNO3中N元素正电荷更高,导致N-O-H中O原子的单子偏向N原子,更易电离出H+,HNO3比HNO2的酸性强,NO3—中N原子的孤电子对数=![]() ×(5+1-3×2)=0,酸根中没有孤对电子的是NO3—,NO2—中N原子的孤电子对数=
×(5+1-3×2)=0,酸根中没有孤对电子的是NO3—,NO2—中N原子的孤电子对数=![]() ×(5+1-2×2)=1,价层电子对数=2+1=3,采用sp2杂化,价电子构型是平面三角型,故答案为:HNO3;NO3— ;平面三角型;
×(5+1-2×2)=1,价层电子对数=2+1=3,采用sp2杂化,价电子构型是平面三角型,故答案为:HNO3;NO3— ;平面三角型;
(5)立方砷化镓晶体与立方氮化硼晶体结构类似,均属于原子晶体,原子半径N<As、B<Ga,故氮化硼中共价键更强,氮化硼的晶体熔点更高,晶胞中As、Ga原子数目均为4,晶胞质量为4×![]() g,晶胞密度为4×
g,晶胞密度为4×![]() g÷(a×10-10 cm)3=
g÷(a×10-10 cm)3=![]() g.cm-3,故答案为:氮化硼;
g.cm-3,故答案为:氮化硼;![]() 。
。


科目:高中化学 来源: 题型:
【题目】已知下图中A是固体单质,E是一种白色沉淀,F为密度最小的无色气体。且各种物质所含元素除H、O外,其余均为第三周期元素。

请按要求回答下列问题:
(1)若实现C→E转化所需的b溶液是“过量的盐酸”,则:B的化学式为__________________,C→E的离子方程式为__________________;
(2)若实现C→E转化所需的b溶液不能使用“过量的盐酸”,只能使用“少量的盐酸”则B的化学式为__________________,C→E的离子方程式为__________________;
(3)若实现C→E转化所需的b溶液是“过量的NaOH溶液”,则:E的化学式为__________________,反应B+a→C+D的离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 在原电池的负极和电解池的阴极上都发生失电子的氧化反应
B. 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1∶2
C. 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH
D. 镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙炔为原料通过以下流程能合成有机物中间体D。
![]()
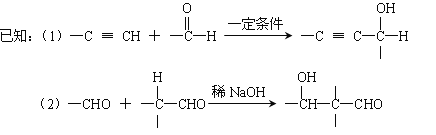
请回答下列问题:
(1)化合物D的分子式为 ,写出D的官能团的名称 。
(2)写出生成A的化学反应方程式: 。
(3)化合物B在浓硫酸催化下,加热与HOOCCOOH反应生成环状酯的化学方程式为: (注明条件)。
(4)化合物C的结构简式为: 。
(5)已知1mol HCHO和1mol CH3CH2CHO发生类似已知(2)的反应,生成1molE。以下关于E的说法正确的是 。
a、E能与H2发生加成反应,也能使酸性高锰酸钾溶液褪色。
b、E属于酯类物质。
c、1molE完全燃烧消耗5molO2.。
d、生成E的反应属于取代反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.硫酸可用于精炼石油、金属加工之前的酸洗
B.氨易液化,常用作制冷剂
C.二氧化硫可用来加工食品,以使食品增白
D.硅是半导体材料,用作光电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
族 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)第三周期元素除⑩外原子半径最小的是______(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),最高价氧化物对应水化物具有两性的是____________,最高价氧化物对应水化物中酸性最强的是__________。
(2)⑥的单质在氯气中燃烧产物的电子式: 。
(3)写出⑦的单质和NaOH溶液反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 某溶液既能溶解Al(OH)3,又能溶解Al,但不能溶解Fe,在该溶液中可以大量共存的离子组是( )
A.K+、Na+、HCO、NO
B.Na+、SO、Cl-、S2-
C.NH、Mg2+、SO、NO
D.H+、K+、Cl-、Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com