

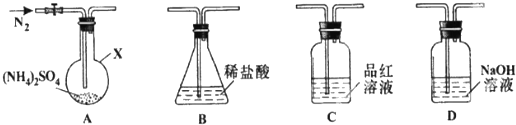
分析 由装置图可知,该实验原理:通过测定干燥管E的质量增重确定二氧化碳的质量,根据二氧化碳的质量计算铁碳合金中碳的质量,进而计算铁的质量,再计算合金中铁的质量分数.故二氧化硫会影响二氧化碳的测定,进入干燥管E的气体应除去二氧化硫、且干燥.
(1)常温下碳与浓硫酸不反应,铁在浓硫酸中发生钝化现象;
(2)碳与浓硫酸在加热的条件下生成二氧化硫、二氧化碳、水;
(3)A中生成的气体含有CO2、2SO2,二氧化硫存在会影响二氧化碳的质量测定,C装置的作用为除尽反应产物中的SO2气体;
(4)合金加热和浓硫酸反应碳和浓硫酸反应生成二氧化碳、二氧化硫和水,铁和浓硫酸反应生成硫酸铁,二氧化硫和水,通过品红验证二氧化硫生成,通过高锰酸钾溶液全部除去二氧化硫,通过浓硫酸干燥后,用装置E中碱石灰吸收二氧化碳,称量增重得到二氧化碳质量,操作中测定二氧化碳质量增大,则铁质量分数减小,二氧化碳质量减小,则铁质量分数增大.
解答 解:由装置图可知,该实验原理:通过测定干燥管E的质量增重确定二氧化碳的质量,根据二氧化碳的质量计算铁碳合金中碳的质量,进而计算铁的质量,再计算合金中铁的质量分数.故二氧化硫会影响二氧化碳的测定,进入干燥管E的气体应除去二氧化硫、且干燥.
(1)常温下,铁与浓硫酸反应生成一层致密的氧化物保护膜,阻止内金属继续与浓硫酸反应,发生钝化现象,
故答案为:常温下Fe遇浓硫酸发生钝化;
(2)碳与浓硫酸在加热的条件下生成二氧化硫、二氧化碳、水,反应方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(3)A中生成的气体含有CO2、2SO2,SO2具有漂白性,能使品红溶液褪色,C装置的作用为除尽反应产物中的SO2气体,防止影响二氧化碳的质量测定,
故答案为:除尽反应产物中的SO2气体;
(4)A.A中反应不完全,导致测定二氧化碳质量减小,铁质量分数增大,故A错误;
B.E中碱石灰会吸收空气中的CO2和H2O,导致测定碳质量增大,合金中铁质量分数减小,故B正确;
C.反应生成的SO2部分被E中碱石灰吸收,导致测定碳质量增大,合金中铁质量分数减小,故C正确;
D.装置内残留部分二氧化碳,未能被装置E完全吸收,导致测量的二氧化碳的质量偏小,即合金中碳元素的质量偏小,铁元素的质量增大,故D错误;
故答案为:BC.
点评 本题考查学生对实验原理的理解、对实验方案与实验装置的评价、元素化合物性质、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.


科目:高中化学 来源: 题型:解答题
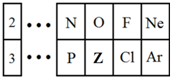 如图是元素周期表的一部分,请回答下列问题.
如图是元素周期表的一部分,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤、石油、天然气是当今世界最重要的三种化石燃料 | |
| B. | 化学反应必然伴随发生能量变化 | |
| C. | 利用生物质能就是间接利用太阳能 | |
| D. | 凡经加热而发生的化学反应都是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在两种溶液中分别加入少量稀硫酸,加热,再加入碱中和硫酸,再加入银氨溶液,水浴加热 | |
| B. | 测量溶液的导电性 | |
| C. | 向两种溶液中分别滴加硝酸银溶液 | |
| D. | 尝味道 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(N2)=0.25mol•L-1•min-1 | B. | v(H2)=0.5mol•L-1•min-1 | ||
| C. | v(NH3)=1mol•L-1•min-1 | D. | v(NH3)=0.25mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH3可以用来做喷泉实验是因为其有特殊气味 | |
| B. | 工业上用氨和二氧化碳合成尿素属于氮的固定 | |
| C. | 液氨作制冷剂原因是其气化时大量吸收周围的热量 | |
| D. | NH3能使无色酚酞溶液变红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com