
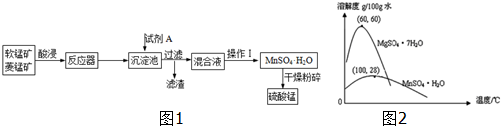
| A. | 试剂A应该选择H2O2,目的是将Fe2+氧化为Fe3+ | |
| B. | 试剂A应该选择氨水,目的是调节溶液的pH | |
| C. | 操作I包括蒸发、冷却、结晶、趁热过滤、洗涤、等步骤,洗涤时可用稀硫酸做洗液 | |
| D. | 在蒸发结晶时,温度应该高于60°C |
分析 软锰矿、菱锰矿酸,二氧化锰具有强氧化性,应将Fe2+氧化为Fe3+,浸后加入试剂A,可起到调节pH的作用,使铁离子水解生成沉淀而除去,将滤液蒸发、结晶得到硫酸锰,分离硫酸锰和硫酸镁,应注意二者溶解度的差异,以此解答该题.
解答 解:软锰矿、菱锰矿酸,二氧化锰具有强氧化性,应将Fe2+氧化为Fe3+,浸后加入试剂A,可起到调节pH的作用,使铁离子水解生成沉淀而除去,将滤液蒸发、结晶得到硫酸锰,
A.试剂A,可起到调节pH的作用,使铁离子水解生成沉淀而除去因二氧化锰具有强氧化性,无需加入过氧化氢,故A错误;
B.A不能是氨水,否则金属离子都生成沉淀,故B错误;
C.操作I用于分离硫酸锰和硫酸镁,包括蒸发、冷却、结晶、趁热过滤、洗涤、等步骤,因硫酸锰晶体易溶于水,不能用硫酸洗涤,故C错误;
D.温度高于60°C,晶体溶解度减小,利于蒸发结晶,故D正确.
故选D.
点评 本题考查混合物的分离和提纯,为高频考点,侧重考查分析实验能力,明确流程图中发生的反应及操作方法是解本题关键,注意把握物质的性质异同以及题给信息,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 含有大量AlO${\;}_{2}^{-}$的溶液中:Na+、OH-、Cl-、CO${\;}_{3}^{2-}$ | |
| B. | 滴加紫色石蕊试液变红的溶液中:K+、Ba2+、CH3COO-、F- | |
| C. | 加入Al能放出H2的溶液中:K+、NH4+、NO3-、HCO3- | |
| D. | 1.0mol?L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入甲烷的电极为电池的负极,通入氧气的电极为正极 | |
| B. | 在标准状况下,每消耗5.6 L O2,可向外提供2.4×104 C的电量 | |
| C. | 通入甲烷电极的电极反应为:CH4+10OH--8e-═CO32-+7H2O | |
| D. | 放电一段时间后,溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如表:
X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如表:| 元素代号 | X | Y | Z | M | Q | R |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.037 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知FeO4n-中Fe的化合价是+6价,则n=2 | |
| B. | 每产生1molCl-,转移2mol电子 | |
| C. | FeO4n-具有强氧化性,一般其还原产物为Fe3+,可用作新型自来水消毒剂和净水剂 | |
| D. | 若n=2,则该反应中氧化剂与还原剂的物质的量之比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 离子半径:Na+>Al3+ | |
| B. | 铝钠合金若投入一定水中可得无色溶液并产生气泡 | |
| C. | 若mg不同组成的铝钠合金投入足量盐酸中,若放出的H2越多,则铝的质量分数越少 | |
| D. | 铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com