
【题目】乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去)。
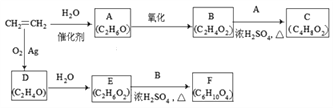
请回答下列问题:
(1)A物质的名称是_________________________。
(2)B和A反应生成C的化学方程式为__________________________________,该反应的类型为____________________。
(3)D为环状化合物,其同分异构体与银氨溶液反应的化学方程式为____________。
(4)F的结构简式为_______________________________。
 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】将某铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3∶2,则样品中铁、铝的物质的量之比为( )
A. 3∶2 B. 2∶1 C. 3∶4 D. 4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向 2.0 L 浓度均为 1.0 mol·L1 的 CuSO4、Fe2(SO4)3 和 H2SO4 的混合液中加入足量的铁粉,反应停止后,铁粉有剩余,此时溶液中 Fe2+ 的物质的量浓度是(溶液的体积变化忽略不计)
A. 1.5 mol·L1 B. 2.0 mol·L1 C. 3.0 mol·L1 D. 5.0 mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不法分子有时用铜锌合金制成假金币行骗。下列方法中,不能有效鉴别真假的是
A. 在空气中灼烧看表面是否变黑
B. 利用阿基米德原理测密度
C. 用手掂量轻重
D. 滴一滴硝酸在金币的表面,观察现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是周期表中短周期的一部分。已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是
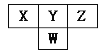
A. 原子半径的大小顺序是W>Y>ZB. X的氢化物没有Z的氢化物稳定
C. 常见的X的氢化物具有正四面体结构D. Y的氢化物比W的氢化物沸点高,是因为分子间存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所示装置正确且能完成相关实验的是( )
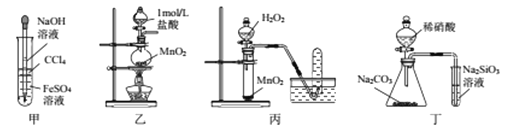
A. 用甲所示装置制取并观察Fe(OH)2 B. 用乙所示装置制取少量Cl2
C. 用丙所示装置制取O2 D. 用丁所示装置比较N、C、Si的非金属性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种元素在元素周期表中序数逐渐增大。X为非金属元素,且X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)X、Y、Z的元素符号分别是:______、_______、________。
(2)画出Z的离子结构示意图__________。
(3)X、Y、Z的简单离子半径大小顺序为________________________________。
(4)用电子式表示W与Z形成化合物W2Z的过程____________________________。
(5)由X、Y、Z所形成的离子化合物是__________,它与W的最高价氧化物对应水化物的溶液加热时反应的离子方程式是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。A中反应方程式是___________________________________(锰被还原为Mn2+)。
②将除杂装置B补充完整并标明所用试剂 :______________________________
③C中得到紫色固体和溶液。C中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH![]() 2K2FeO4+6KCl+8H2O,另外还有____________________________________(写离子方程式)。
2K2FeO4+6KCl+8H2O,另外还有____________________________________(写离子方程式)。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
i.由方案Ⅰ中溶液变红可知a中含有_______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由__________________________________________产生(用方程式表示)。
ii.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是______________________________。
②根据K2FeO4的制备实验得出:氧化性Cl2_______FeO42-(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com