
【题目】某烷烃在氧气中完全燃烧,生成物先通过浓硫酸,再通过碱石灰,如果生成物完全全被二者吸收,浓硫酸增重27g,碱石灰增重44g。该有机物的化学式为
A.CH4B.C2H6C.C3H8D.C4H10
科目:高中化学 来源: 题型:
【题目】(1)基态Cl原子中,电子占据的最高能层具有的原子轨道数为____。
(2)NH4CuSO3中金属阳离子的价电子排布式为________。N、O、S三种元素的第一电离能由大到小的顺序为________ (填元素符号)。
(3)氨基乙酸钠(H2NCH2COONa)中中心原子N原子的价层电子对数为________,C原子的杂化方式为________,1 mol氨基乙酸钠中含有σ键的数目为________。
(4)向CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]SO4溶液,在[Cu(NH3)4]2+中配原子为________。
(5)MgO和CaO均为离子晶体,两者的熔融混合物冷却时,先析出的晶体是____,原因是________
(6)BN的熔点是3000℃,密度为d g·cm-3,其晶胞结构如图所示,晶体中一个B原子周围距离最近的N原子有________个;若原子半径分别为rN pm和rB pm,阿伏加德罗常数值为NA,则BN晶胞中原子的体积占晶胞体积的百分率为__________(用含d、rN 、rB、NA的式子表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,5.6L A气体的质量是15g,则A的摩尔质量为___。
(2)一定量的液态化合物XY2,在一定量的O2中恰好完全燃烧,反应方程式为:XY2(液)+ 3O2(气)= XO2(气)+2YO2(气),冷却后,在标准状况下测得生成物的体积是672mL,密度是2.56g/L,则:
①反应前O2的体积是______。
②化合物XY2的摩尔质量是____。
③若XY2分子中X、Y两元素的质量之比为3:16,则X、Y两元素分别是_____和_____。(写元素符号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Fe3+、CO32-、SO42-、H+,现取三份100mL溶液进行如下实验:(已知NH4++OH-![]() NH3+H2O;MgCO3是微溶物)(1)第一份加入足量AgNO3溶液有沉淀产生(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是( )
NH3+H2O;MgCO3是微溶物)(1)第一份加入足量AgNO3溶液有沉淀产生(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是( )
A. K+一定存在B. 100mL溶液中含0.01mol CO32-
C. Cl-一定存在D. Fe3+一定不存在,Mg2+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)有下列几组物质,请将序号填入下列空格内:
A、CH2=CH-COOH和油酸(C17H33COOH)
B、C60和石墨
C、![]() 和
和![]()
D、35Cl和37Cl
E、乙醇和乙二醇
①互为同位素的是______________;
②互为同系物的是_________________;
③互为同素异形体的是__________;
④互为同分异构体的是_____________;
(2)梯恩梯(TNT)结构简式为____________________________;
(3)某有机聚合物物结构为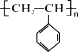 ,试回答下列问题:
,试回答下列问题:
①有机物名称是___________________,链节为______。
②实验测得该高聚物的相对分子质量(平均值)为52000,则该高聚物的聚合度n为________。
(4)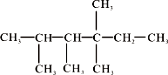
①有机物名称是__________________________。
②此有机物为烯烃加成的产物,则原来烯烃的结构可能有_______种。
(5)某物质结构如图所示,分子式为_________________;该物质可以与下列_____(填序号)发生反应。
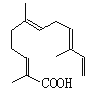
A.酸性KMnO4溶液 B.氢气
C.溴水 D.NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出如图中序号①~④仪器的名称:
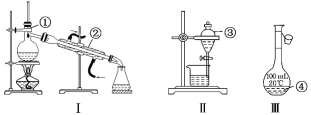
(1)①_____;②____;③_____;④_____。
(2)仪器①~④中,使用时必须检查是否漏水的有____(填仪器序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. “84”消毒液中:SiO32-、CO32-、Na+、K+
B. ![]() 的溶液中NH4+、Ca2+、C1-、NO3-
的溶液中NH4+、Ca2+、C1-、NO3-
C. 0.1mol/LNaA1O2溶液中:HCO3-、NH4+、SO32-、Fe3+
D. pH=1的溶液中:Na+、K+、Cl-、S2O32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 煤是复杂的混合物,含有苯、甲苯、二甲苯等一系列重要的化工原料
B. 石油分馏得到的汽油、煤油、柴油等都有固定的熔沸点
C. 石油炼制的目的是为了获得轻质油和重要化工原料(乙烯、丙烯等)
D. 天然气和沼气的主要成分是乙烯,它们都属于不可再生能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰是一种重要的化工中间体,是锰行业研究的热点。一种以高硫锰矿(主要成分为含锰化合物及FeS)为原料制备硫酸锰的工艺流程如下:

已知:①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO。
②金属离子在水溶液中的平衡浓度与pH的关系如图所示(25℃):

③此实验条件下Mn2+开始沉淀的pH为7.54;离子浓度≤10-5mol·L-1时,离子沉淀完全。
请回答:
(1)传统工艺处理高硫锰矿时,不经“混合焙烧”,而是直接用H2SO4浸出,其缺点为___________。
(2)“氧化”时,发生反应的离子方程式为_________________________________。若省略“氧化”步骤,造成的后果是_________________________________。
(3)“中和除杂”时,生成沉淀的主要成分为______________________(填化学式)。
(4)“氟化除杂”时,若使溶液中的Mg2+和Ca2+沉淀完全,需维持c(F-)不低于___________。(已知:Ksp(MgF2)=6.4×10-10;Ksp(CaF2)=3.6×10-12)
(5)“碳化结晶”时,发生反应的离子方程式为______________________。
(6)“系列操作”指___________、过滤、洗涤、干燥
(7)用惰性电极电解MnSO4溶液可制备MnO2,电解过程中阳极的电极反应式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com