
【题目】运用化学反应原理研究化学反应有着非常重要的意义。
(一)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)![]() 2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
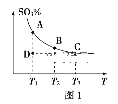
①2SO2(g)+O2(g)![]() 2SO3(g)的ΔH___0(填“>”或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡___移动(填“向左”“向右”或“不”)。
2SO3(g)的ΔH___0(填“>”或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡___移动(填“向左”“向右”或“不”)。
②若反应进行到状态D时,v(正)___v(逆)(填“>”“<”或“=”)。
(二)工业上合成氨技术叫哈伯法:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,此法达到平衡时反应物的转化率不高。
2NH3(g) ΔH<0,此法达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是___(填编号)。
A.使用更高效的催化剂
B.升高温度
C.及时分离出氨气
D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)=__。

从11min起,压缩容器的体积为1L,则n(N2)的变化曲线为___(填编号)。
A.a B.b C.c D.d
【答案】< 左 > D 0.06mol·L-1·min-1 D
【解析】
(一)①根据图像,可以判断出该反应是放热反应,则ΔH<0;若在恒温、恒压条件下向上述平衡体系中通入氦气,容器的体积增大,相当于恒容减小压强,则平衡向左移动;
(二)①根据平衡移动的速率图像分析即可;
②通过N2的反应速率来计算H2的反应速率,再通过平衡的移动来分析N2物质的量的变化趋势。
(一)①由图知,随着温度升高,体系中SO3的百分含量降低,说明平衡逆向移动,则该反应的正反应是放热反应,故ΔH<0;若在恒温、恒压条件下向上述平衡体系中通入氦气,容器的体积增大,相当于恒容减小压强,平衡向气体体积增大的方向进行,即平衡向左移动;
②T1℃时,D点的SO3的百分含量比A点(平衡时)低,则平衡向SO3的百分含量增大的方向进行,即平衡正向移动,故v(正)>v(逆);
(二)①A、使用催化剂,反应速率增大,但是平衡不移动,A错误;
B、该反应是放热反应,升高温度,反应速率增大,但是平衡逆向移动,B错误;
C、及时分离出氨气,降低了生成物的浓度,平衡正向移动,但是也会降低反应速率,C错误;
D、增大氮气的浓度,可加快反应速率,且平衡正向移动,D正确;
故选D;
②v(N2)=![]() =0.02mol·L-1·min-1,v(H2)=3v(N2)=3×0.02mol·L-1·min-1=0.06mol·L-1·min-1;从11min起,压缩容器体积,则体系压强增大,平衡正向移动,N2的浓度减小,故选D。
=0.02mol·L-1·min-1,v(H2)=3v(N2)=3×0.02mol·L-1·min-1=0.06mol·L-1·min-1;从11min起,压缩容器体积,则体系压强增大,平衡正向移动,N2的浓度减小,故选D。


科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列表示物质变化的化学用语中正确的是( )
A. 汽车用的铅蓄电池充电时阳极反应:PbSO4+2H2O-2e-=PbSO4+4H++SO42-
B. 利用Na2CO3溶液可除油污:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
C. BaSO4的水溶液导电性极弱: BaSO4![]() Ba2++SO42-
Ba2++SO42-
D. 用醋酸除去暖瓶中的水垢:2H++ CaCO3=Ca2++CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在一固定容积的密闭容器中发生反应:A(g)+B(g)![]() C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是
C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是

A. T℃时,该反应的平衡常数值为4
B. c点没有达到平衡,此时反应向逆向进行
C. 若c点为平衡点,则此时容器内的温度高于T℃
D. T℃时,直线cd上的点均为平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率的理解正确的是( )
A.化学反应速率是指单位时间内任一种反应物浓度的减少或生成物浓度的增加
B.化学反应速率是指某一时刻,某种反应物的瞬时速率
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越大,反应现象越明显
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H+、Na+、Al3+、Ba2+、OH、![]() 、Cl七种离子形成了甲、乙、丙、丁四种化合物,它们之间可以发生如图所示转化关系(产物H2O未标出),下列说法不正确的是
、Cl七种离子形成了甲、乙、丙、丁四种化合物,它们之间可以发生如图所示转化关系(产物H2O未标出),下列说法不正确的是

A.白色沉淀A可能能溶解在溶液D中
B.在甲中滴加丁可能发生反应:![]() +Ba2++OHBaCO3↓+H2O
+Ba2++OHBaCO3↓+H2O
C.溶液丙与I、![]() 、
、![]() 可以大量共存
可以大量共存
D.溶液甲中一定满足:c(H2CO3)+c(H+)=c(OH)+c(![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200℃时,将a mol H2(g)和b mol I2(g)充入到体积为V L的密闭容器中,发生反应:I2(g)+H2(g)2HI(g)。
(1)反应刚开始时,由于c(H2)=______,c(I2)=______,而c(HI)=________,所以化学反应速率________最大而________最小(为零)(填“v正”或“v逆”)。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)________,c(I2)________,而c(HI)________,从而化学反应速率v正________,而v逆________(填“增大”、“减小”或“不变”)。
(3)当反应进行到v正与v逆________时,此可逆反应就达到了最大限度,若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或处理事故的方法正确的是( )
A.用干燥的pH试纸测定NaClO溶液的pH
B.在耐高温的石英坩埚中进行熔化氢氧化钠固体的实验
C.用分液漏斗分离乙酸乙酯和水的混合物时,水从下口放出,乙酸乙酯从上口倒出
D.欲配制质量分数为10%的硫酸铜溶液,可准确称取10 g硫酸铜晶体溶于90 g水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同
B.配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度
C.用加热的方法可以除去KCl溶液中的Fe3+
D.为抑制Fe3+的水解,较好地保存FeCl3溶液,应加少量盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 L含有0.4 mol Cu(NO3)2和0.4 mol KCl的水溶液,用惰性电极电解一段时间后,在一电极上析出19.2 g Cu。此时,在另一电极上放出气体的体积在标准状况下为(不考虑产生的气体在水中的溶解)( )
A.6.72 LB.13.44 LC.3.36 LD.5.6 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com