
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、Al3+和五种阴离子Cl-、OH-、NO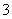 、CO
、CO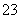 、X中的一种。
、X中的一种。
(1) 某同学通过比较分析认为无须检验就可判断其中必有的两种物质是_______ 和_________。
(2) 物质C中含有离子X。为了确定X,现将(1)中的两种物质记为A和B,当C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体,则X为________(填字母)。
A.Br- B.SO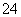 C.CH3COO- D.HCO
C.CH3COO- D.HCO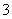
(3) 将19.2 g Cu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,写出Cu溶解的离子方程式 ,若要将Cu完全溶解,至少加入H2SO4的物质的量是____________________。
(4) E溶液与氢碘酸反应时可生成棕色物质,该反应的离子方程式为 。
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
已知NH4CuSO3与足量的10 mol/L硫酸混合微热,产生下列现象:①有红色金属生成
②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是
A.反应中硫酸作氧化剂 B.NH4CuSO3中硫元素被氧化
C.刺激性气味的气体是氨气 D.1 mol NH4CuSO3完全反应转移0.5 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过反应:Al2O3+N2+3C
 2AlN+3CO合成。下列叙述正确的是 ( )
2AlN+3CO合成。下列叙述正确的是 ( )
A.上述反应中,N2是氧化剂,被氧化。
B.上述反应中,每生成1 mol AlN需转移3 mol电子
C.AlN中氮的化合价为+3
D.AlN的摩尔质量为41 g
查看答案和解析>>
科目:高中化学 来源: 题型:
用右图所示装置进行实验,下列对实验现象的解释不合理的是
| ①中试剂 | ①中现象 | 解 释 | |
| A | Ba(NO3)2溶液 | 生成白色沉淀 | SO32-与Ba2+生成白色BaSO3沉淀 |
| B | 品红溶液 | 溶液褪色 | SO2具有漂白性 |
| C | 紫色石蕊溶液 | 溶液变红 | SO2与水反应生成酸 |
| D | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 |
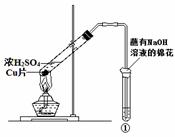
查看答案和解析>>
科目:高中化学 来源: 题型:
下列依据相关实验得出的结论正确的是
A.向某溶液中加入稀盐酸,产生的气体通入澄清石灰水石灰水变浑浊,该溶液一定是碳酸盐溶液
B.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
C.将某气体通入溴水中,溴水颜色褪去,该气体一定是SO2
D.向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
可以说明乙酸是弱酸的事实是( )
|
| A. | 乙酸不能使酚酞溶液变红色 | B. | 0.1 mol•L﹣1的乙酸溶液pH>1 |
|
| C. | 乙酸能使紫色石蕊试液变红色 | D. | 乙酸和Na2CO3反应可放出CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在2A+B═3C+4D反应中,下面表示的化学反应速率最快的是( )
A.v(A)=0.5mol/(L•min) B.v(B)=0.05mol/(L•min)
C.v(C)=0.9mol/(L•min) D.v(D)=1.0mol/(L•min)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/°C | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=________,ΔH________0(填“<”“>”“=”);
(2)830°C时,向一个5 L的密闭容器中充入0.20 mol的A和0.80 mol的B,如反应初始6 s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6 s时C的物质的量为______mol;若反应经一段时间后,达到平衡时A的转化率为________,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为________;
(3)判断该反应是否达到平衡的依据为________(填正确选项前的字母);
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
从反应类型的角度来看,下列化学反应中,与其他三个类型不同的是( )
A.锌粒与稀硫酸反应制取氢气
B.铁粉投入硫酸铜溶液中析出铜
C.金属钠投入水中产生氢气和氢氧化钠
D.一氧化碳与三氧化二铁加热生成金属铁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com