
【题目】同温同压下,四个等体积的干燥圆底烧瓶中分别充满:①NH3②HCl(混有少量空气),③NO2 , ④NO2和O2(4:1)的混合气体,进行喷泉实验,经充分反应后,圆底瓶内溶液的物质的量浓度为(设溶质不扩散)( )
A.①>②>③>④
B.①=②=③=④
C.①=②=③>④
D.①>②>③=④
【答案】C
【解析】解:①设体积为3L,纯净的氨气,完全溶于水,溶液的体积等于烧瓶容积,所以溶液浓度为 ![]() =
= ![]() mol/L;②HCl完全溶于水,剩余少量空气,溶液体积与HCl体积相等,所以溶液物质的量浓度为
mol/L;②HCl完全溶于水,剩余少量空气,溶液体积与HCl体积相等,所以溶液物质的量浓度为 ![]() =
= ![]() mol/L;③纯净的NO2气体,发生反应3NO2+H2O=2HNO3+NO,生成硝酸2mol,1molNO,所以溶液体积等于烧瓶容积的
mol/L;③纯净的NO2气体,发生反应3NO2+H2O=2HNO3+NO,生成硝酸2mol,1molNO,所以溶液体积等于烧瓶容积的 ![]() ,所以溶液的物质的量浓度为
,所以溶液的物质的量浓度为 ![]() =
= ![]() mol/L;④NO2和O2(4:1)的混合气体,发生反应为:4NO2+O2+2H2O=4HNO3 , 这样5份的气体(4NO2+O2)生成4份HNO3 , 溶液体积等于二氧化氮与氧气的体积和,故浓度为
mol/L;④NO2和O2(4:1)的混合气体,发生反应为:4NO2+O2+2H2O=4HNO3 , 这样5份的气体(4NO2+O2)生成4份HNO3 , 溶液体积等于二氧化氮与氧气的体积和,故浓度为 ![]() =
= ![]() mol/L,故溶液浓度①=②=③>④. 故选:C.
mol/L,故溶液浓度①=②=③>④. 故选:C.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1) 某浓度的氨水中存在平衡:NH3·H2O ![]() NH4+ + OH-,如想增大NH4+的浓度而不增大OH-的浓度,可采取的措施是___________填字母)。
NH4+ + OH-,如想增大NH4+的浓度而不增大OH-的浓度,可采取的措施是___________填字母)。
a.适当升高温度 b.加入NH4Cl固体
c.通入NH3 d.加入少量浓盐酸
(2) 常温下,有pH相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
①加适量醋酸钠晶体后,两溶液中的c(H+)变化情况是:
醋酸溶液中c(H+) _____________________(填“增大”、“减小”或“不变”),盐酸溶液中c(H+) __________________(填“增大”、“减小”或“不变”)
②加水稀释10倍后:醋酸溶液中的c(H+)________盐酸溶液中的c(H+)(填“>”、“=”或“<”)。
③加等浓度的NaOH溶液至恰好中和,所消耗的NaOH溶液体积相比较:醋酸_____________盐酸(填“>”、“=”或“<”)。
④使温度都升高20 ℃后,两溶液中c(H+)比较:醋酸____________盐酸(填“>”、“=”或“<”)。
⑤ 分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是_________________(填字母,①代表盐酸,②代表醋酸溶液)。

(3) 将0.1 mol·L-1的CH3COOH加水稀释,有关稀释后醋酸溶液的说法中,正确的是_________________ (填字母)。
a.电离程度增大 b.溶液中离子总数增多
c.溶液导电性增强 d.溶液中醋酸分子增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:电池:Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l)。电解池:2Al+3H2O![]() Al2O3+3H2↑,电解过程中,以下判断正确的是
Al2O3+3H2↑,电解过程中,以下判断正确的是
电池 | 电解池 | |
A | H+移向Pb O2电极 | H+移向Pb电极 |
B | 每消耗3mol Pb | 生成2 mol Al2O3 |
C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
D |
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应及其应用在化学中占有重要地位。回答下列各题。
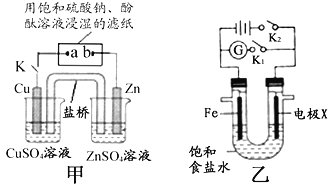
(1)写出铝与氢氧化钠溶液反应的离子方程式____________________;若将镁条、铝条和灵敏电流计用导线相连,使镁条、铝条浸入氢氧化钠溶液中,电流计指针发生偏转时,负极材料为________。
(2)当闭合K时,甲装置中Zn极的电极反应式为____;电子流动的方向为______;若盐桥中填充KCl琼脂,K+离子移动的方向为______;a极的电极反式为________;一段时间后,b极附近的现象为____________________。
(3)装置乙中。
①断开K2,接通K1。当X为石墨电极,Fe极的电极反应式为_________;当X为锌电极,Fe极的电极反应式为_____________。
②断开K1,接通K2。若X为石墨电极,X极的电极名称为_____;装置反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应速率和化学反应限度具有重要意义。回答下列问题:
(Ⅰ)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10mL2% H2O2溶液 | 无 |
② | 10mL5% H2O2溶液 | 无 |
③ | 10mL5% H2O2溶液 | 1mL0.1molL-1FeCl3溶液 |
④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1molL-1FeCl3溶液 |
⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1molL-1FeCl3溶液 |

(1)实验①和②的目的是____________________________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进措施是_________________________________________。
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析图能够得出的实验结论是__________________________________。
(Ⅱ)丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈CH3CN等。
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①CH2=CHCH3(g)+NH3(g)+ 3/2 O2(g)→ CH2=CHCN(g)+3H2O(g) △H=-515 kJ/mol
②CH2=CHCH3(g)+ O2(g)→C3H4O(g)+H2O(g) △H=-353 kJ/mol
有利于提高丙烯腈平衡产率的反应条件是_______________;提高丙烯腈反应选择性的关键因素是__________。
(2)丙烯腈和丙烯醛的产率与n(NH3)/n (丙烯)的关系如图所示。由图可知,最佳n(NH3)/n (丙烯)约为________,理由是________________。氨、丙烯、空气的进料理论体积比约为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1molL—1二元弱酸H2A溶液的pH,溶液中的H2A、HA—、A2—的物质的量分数δ(x)随pH的变化如图所示[已知δ(x)=c(x)/(c(H2A)+c(HA—)+c(A2—)])。下列叙述正确的是

A. Ka2(H2A)的数量级为10-4
B. NaHA溶液中,HA-的水解能力小于HA-的电离能力
C. 在含H2A、HA-和A2-的溶液中,加入少量NaOH固体,δ(HA-)一定增大
D. 将等物质的量的NaHA和Na2A混合物溶于水,所得的溶液中δ(HA-)=δ(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如图实验流程探宄海带中碘含量的测定和碘的制取. 
已知:己知:3I2+6NaOH═5NaI+NaIO3+3H2O 请回答:
(1)实验中仪器的名称:A , B .
(2)①与②的操作名称(填“相同”或“不相同”)
(3)步骤X为向海带原液中滴加0.0100mol/LAgNO3溶液,当海带原液中不再生成沉淀时,消耗 AgNO3溶液20.00mL,计算得海带中碘的百分含量为 .
(4)步骤Y中,萃取后分液漏斗内观察到的现象是 .
(5)方案甲中采用蒸馏不合理,理由是 .
(6)下列有关步骤Z的说法,正确的是 .
A.应控制NaOH溶液的浓度和体积
B.将碘转化成离子进入水层
C.NaOH溶液可以由乙醇代替.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列洗涤方法正确的是( )
A.粘附在试管内壁上的硫,用酒精洗涤
B.苯酚不小心滴在皮肤上,用氢氧化钠洗涤
C.做银镜反应后试管壁上的银镜,用稀硫酸洗涤
D.沾附在瓷盘上的油脂用热的纯碱溶液洗涤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com