
【题目】纯净干燥的氯气与熔融金属锡反应可制备 SnCl4,某化学小组的同学设计了如下实验装置进行制备。
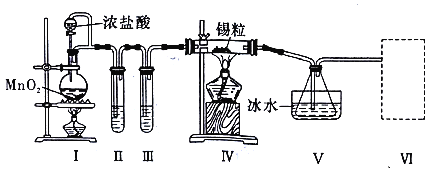
已知:①金属锡熔点为 231℃,化学活泼性与铁相似;②SnCl4 的沸点为 114℃;③SnCl4 易与水反应。
请根据上图装置回答:
(1)装置Ⅳ中发生反应的化学方程式为__________________________。
(2)试管II中的试剂是___________________,装置 V 的作用是______________。
(3)裝置Ⅵ最好选用下列装置中的______________________(填标号)。
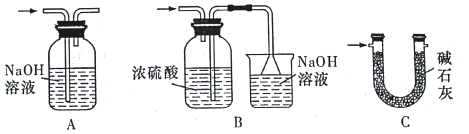
(4)实验结束后,欲回收利用装置Ⅰ中未反应完的 MnO2,需要的分离方法___________。
(5)为了顺利完成实验,点燃酒精灯的正确操作是___________________(填字母)。
A.先点燃 I 处酒精灯,后点燃Ⅳ处酒精灯
B.先点燃Ⅳ处酒精灯,后点燃 I 处酒精灯
C.同时点燃 I、Ⅳ两处酒精灯
【答案】Sn+2Cl2 ==SnCl4 饱和食盐水 冷却和收集SnCl4 C 过滤 A
【解析】
装置I制备氯气,制备的氯气中含有HCl、水蒸气,装置II吸收HCl,装置III干燥氯气,装置IV中氯气与Sn反应生成SnCl4,装置V冷却和收集SnCl4,SnCl4遇水水解,装置VI防止水蒸气加入V中,氯气有毒,直接排放会污染空气,装置VI吸收氯气,据此分析作答。
(1)装置Ⅳ中氯气与Sn在加热条件下生成SnCl4,反应方程式为:Sn+2Cl2 ![]() SnCl4;
SnCl4;
故答案为:Sn+2Cl2 ![]() SnCl4;
SnCl4;
(2)生成的氯气中含有氯化氢和水蒸气,首先除去氯化氢,利用饱和食盐水,然后利用浓硫酸干燥氯气,即试管II中的试剂是饱和食盐水;SnCl4的沸点为114℃,因此装置V的作用是冷凝(收集)SnCl4,
故答案为:饱和食盐水;冷却和收集SnCl4;
(3)氯气有毒,需要尾气处理,另外SnCl4易与水反应,需要防止空气中的水蒸气进入,所以装置Ⅵ中试剂最好选用碱石灰,
故答案选C;
(4)二氧化锰不溶于水,实验结束后,欲回收利用装置Ⅰ中未反应完的MnO2,需要过滤,
故答案为:过滤;
(5)根据题中信息可知:锡能与氧气反应,故应先通氯气排除装置中的空气,防止锡与空气中的氧气反应,所以在加热制备SnCl4,故先点燃A处酒精灯,后点燃D处酒精灯;
故答案为:A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】通过一步反应不能直接完成的是
①N2→NO2 ②NO2→NO ③NH3→NO ④NO→HNO3 ⑤Cu→Cu(NO3)2 ⑥HNO3→NO2
A. ①⑤B. ①C. ①④⑥D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用某种仪器量取液体体积时,平视时读数为x mL,仰视时读数为y mL,俯视时读数为z mL,若y<x<z,则所用仪器可能是( )
A. 酸式滴定管 B. 碱式滴定管 C. 量筒 D. 以上仪器都不是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下图所示实验,下列实验现象预测或操作正确的是
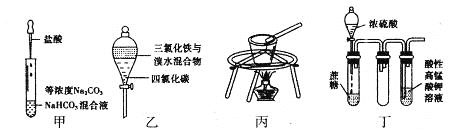
A. 实验甲:匀速逐滴滴加盐酸时,试管中没气泡产生和有气泡产生的时间段相同
B. 实验乙:充分振荡后静置,下层溶液为橙红色,上层为无色
C. 实验丙:用瓷坩埚融化NaOH
D. 装置丁:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以CuSO4溶液和不同酸根离子形成的钠盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
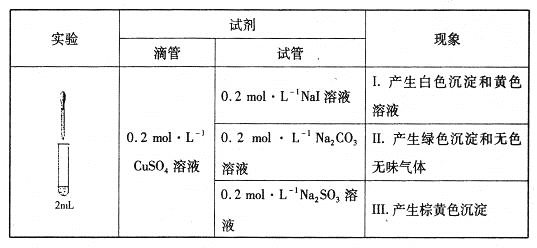
(1)经检验,现象I的白色沉淀为CuI,则反应的离子方程式为_____________________,氧化产物与还原产物的物质的量之比为____________。
(2)经检验,现象Ⅱ中产生的气体是二氧化碳,绿色沉淀是碱式碳酸铜[xCuCO3·yCu(OH)2·zH2O]。现采用氢气还原法测定碱式碳酸铜组成,请回答如下问题:
①写出xCuCO3·yCu(OH)2·zH2O与氢气反应的化学方程式__________________________________________________;
②实验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填仪器接口字母编号):a→_______→g f→____→_____→_____→l

(3)经检验,现象Ⅲ的棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-。
已知:Cu+![]() Cu+Cu2+
Cu+Cu2+
①用稀硫酸证实沉淀中含有Cu+的实验现象是______________________________。
②通过下列实验证实,沉淀中含有Cu2+和SO32-
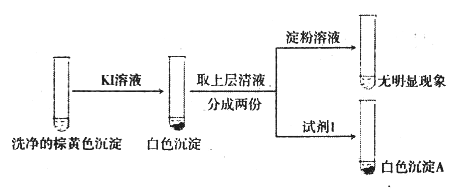
a.白色沉淀A是BaSO4,试剂1是_____________________。
b.证实沉淀中含有Cu+和SO32-的理由是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)是全球硫循环的重要中间体,也是有机合成中的重要原料,是化学工作者重要的研究对象。已知:
Ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g) △Hl=-17kJ/mol;
H2S(g)+CO(g) △Hl=-17kJ/mol;
Ⅱ.COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H2=-35kJ/mol。
H2S(g)+CO2(g) △H2=-35kJ/mol。
回答下列问题:
(1)反应CO(g)+H2O(g)![]() H2(g)+CO2(g)的△H=________。
H2(g)+CO2(g)的△H=________。

(2)在充有催化剂的恒压密闭容器中进行反应I。设起始充入的n(COS):n(H2)=m,相同时间内测得COS转化率与m和温度(T)的关系如图所示。
①m1________m2(填>、<或=)。
②温度高于T0时,COS转化率减小的可能原因为_________。
A.有副反应发生。 B.反应的△H增大。
C.催化剂活性降低。 D.逆反应速率增大的倍数大于正反应速率增大的倍数
(3)在恒温、恒容密闭容器中.进行反应I。下列说法中能说明反应I已达到平衡状态的是____。
A.c(H2S)=c(CO) B.v正(H2)=v逆(H2S)
C.容器中气体密度保持不变 D.容器中混合气体平均摩尔质量保持不变
E.c(COS)保持不变
(4)某温度下,向体积为2 L的恒容密闭容器中通入5 mol COS(g)和5 molH2O(g),发生反应Ⅱ,5 min后反应达到平衡,测得COS(g)的转化率为60%。
①反应从起始至5 min内,用H2S浓度变化表示的平均反应速度v(H2S)=________。
②该温度下,上述反应的平衡常数K=________。
③其他条件相同时,既能使上述反应中COS的平衡转化率增大,又能使反应速率加快的做法是________。
A.缩小容器容积 B.升高温度
C.分离出硫化氢 D.加入一定量H2O(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )

A. A是Zn,B是Cu,C为稀硫酸
B. A是Cu,B是Zn,C为稀硫酸
C. A是Fe,B是Ag,C为稀AgNO3溶液
D. A是Ag,B是Fe,C为稀AgNO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com