
【题目】随着原子序数的递增,下列选项中元素的性质不呈现周期性的变化的是( )
A.化合价
B.原子半径
C.元素的金属性和非金属性
D.相对原子质量
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)写出上述实验中发生反应的化学方程式: 。
(2)实验结果表明,催化剂的催化效果与 有关。
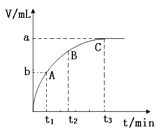
(3)某同学在10 mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的反应速率最慢的是 。
Ⅱ.某反应在体积为5L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如右下图所示(A,B,C均为气体,且A气体有颜色)。
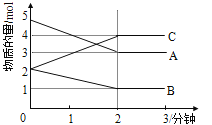
(4)该反应的的化学方程式为 。
(5)反应开始至2分钟时,B的平均反应速率为 。
(6)能说明该反应已达到平衡状态的是 。
a.v(A)= 2v(B) b.容器内各物质的物质的量相等
c.v逆(A)=v正(C) d.容器内气体的颜色保持不变
(7)由图求得平衡时A的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
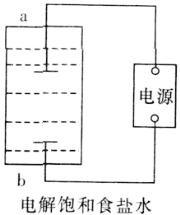
【题目】某兴趣小组模拟氯碱工业生产原理并探究其产品的性质。已知文献记载:
①氯气与冷的氢氧化钠溶液反应生成NaClO;氯气与热的氢氧化钠溶液反应可生成NaClO和NaClO3。②在酸性较弱时KI只能被NaClO氧化,在酸性较强时亦能被NaClO3氧化。
(1)该小组利用如图所示装置制取家用消毒液(主要成分为NaClO),则a为_______(填“阳极”或“阴极”)。生成NaClO的离子方程式为________。
(2)该小组将0.784L(标准状况)Cl2通入50.00mL热的NaOH溶液中,两者恰好完全反应后,稀释到250.0mL。
Ⅰ.取稀释后的溶液25.00mL用醋酸酸化,加入过量KI溶液。用0.2000mol·L-1 Na2S2O3溶液滴定:I2+2S2O32-=2I-+S4O62-,消耗Na2S2O3溶液10.00mL时恰好到达终点。
Ⅱ.将上述滴定后的溶液用盐酸酸化至强酸性,再用上述Na2S2O3溶液滴定到终点,需Na2S2O3溶液30.00mL。
①操作Ⅱ中氯酸钠与碘化钾反应的离子方程式为________。
②反应后的溶液中次氯酸钠和氯酸钠的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象预测不正确的是
A. 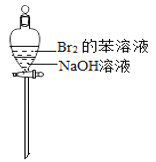 振荡后静置,上层溶液颜色变浅或者褪去
振荡后静置,上层溶液颜色变浅或者褪去
B. 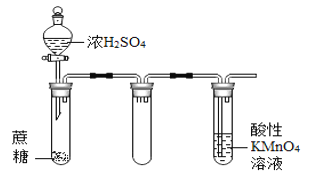 酸性KMnO4溶液中出现气泡,且颜色逐渐褪去
酸性KMnO4溶液中出现气泡,且颜色逐渐褪去
C. 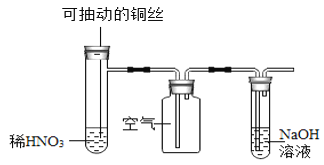 微热稀HNO3片刻,溶液中有气泡产生,广口瓶内变为红棕色
微热稀HNO3片刻,溶液中有气泡产生,广口瓶内变为红棕色
D. 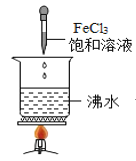 滴入FeCl3饱和溶液后,可形成带电的胶体,该分散系导电能力增强
滴入FeCl3饱和溶液后,可形成带电的胶体,该分散系导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
① | ||||||||
② | ③ | |||||||
④ | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)④在周期表中的位置是______,③的最简单氢化物的电子式______。
(2)②、⑥、⑧对应的最高价含氧酸的酸性由强到弱的顺序是______(填化学式)。
(3)①、②、③三种元素形成的化合物M中原子个数比为4∶2∶3,M中含有的化学键类型有______。
(4)能说明⑦的非金属性比⑧的非金属性______(填“强”或“弱”)的事实是______(用一个化学方程式表示)。
(5)⑤、⑧两元素最高价氧化物对应水化物相互反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列反应中,在理论上可设计成原电池的化学反应是________(填序号),理由是_____________________________________________________。
A.C(s)+H2O(g)===CO(g)+H2(g) ΔH>0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)===BaCl2(aq)+2NH3·H2O(l)+8H2O(l) ΔH>0
C.CaC2(s)+2H2O(l)===Ca(OH)2(s)+C2H2(g) ΔH<0
D.CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH<0
(2)电解原理在化学工业中有着广泛的应用,现将你设计的原电池通过导线与右图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:
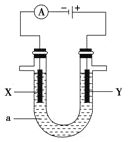
①若X和Y均为惰性电极,a为饱和的NaCl溶液,则电解时,
检验Y电极反应产物的方法是__________________________________________。
②若X、Y分别为石墨和铁,a仍为饱和的NaCl溶液,则电解过程Y电极的电极反应式是___________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1mol/L的CH3COOH溶液中存在如下电离平衡CH3COOH![]() CH3COO-+H+ 对于该平衡,下列叙述正确的是
CH3COO-+H+ 对于该平衡,下列叙述正确的是
A. 加入少量NaOH固体,平衡向正反应方向移动
B. 加水,反应速率增大,平衡向逆反应方向移动
C. 滴加少量0.1mol/L HCl溶液,溶液中C(H+)减少
D. 加入少量CH3COONa固体,溶液的pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进行下列实验,相关说法正确的是
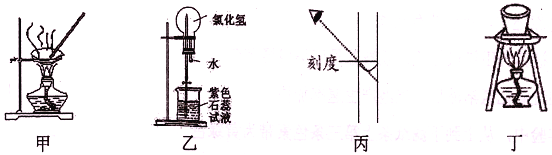
A. 图甲:蒸干NH4Cl饱和溶液制备NH4Cl晶体
B. 图乙:形成美丽的红色喷泉,证明HC1极易溶于水
C. 图丙:配制一定物质的量浓度的NaOH溶液,定容时如图则所配NaOH溶液浓度偏低
D. 图丁:所示装置用于除去碳酸氢钠固体中的少量碳酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯净干燥的氯气与熔融金属锡反应可制备 SnCl4,某化学小组的同学设计了如下实验装置进行制备。
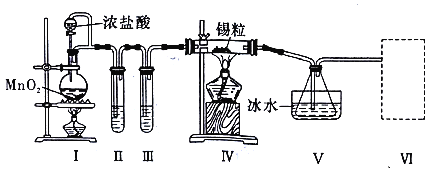
已知:①金属锡熔点为 231℃,化学活泼性与铁相似;②SnCl4 的沸点为 114℃;③SnCl4 易与水反应。
请根据上图装置回答:
(1)装置Ⅳ中发生反应的化学方程式为__________________________。
(2)试管II中的试剂是___________________,装置 V 的作用是______________。
(3)裝置Ⅵ最好选用下列装置中的______________________(填标号)。
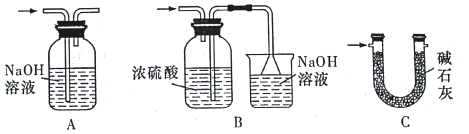
(4)实验结束后,欲回收利用装置Ⅰ中未反应完的 MnO2,需要的分离方法___________。
(5)为了顺利完成实验,点燃酒精灯的正确操作是___________________(填字母)。
A.先点燃 I 处酒精灯,后点燃Ⅳ处酒精灯
B.先点燃Ⅳ处酒精灯,后点燃 I 处酒精灯
C.同时点燃 I、Ⅳ两处酒精灯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com