
【题目】将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )

A | B | C | D | |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A. A B. B C. C D. D
【答案】B
【解析】A、石灰水中通入二氧化碳,先发生反应Ca(OH)2+CO2=CaCO3↓+H2O,生成CaCO3沉淀,Ca(OH)2反应完后,继续通入CO2反应CaCO3+CO2+H2O=Ca(HCO3)2,沉淀消失,前后两个过程CO2的物质的量之比为1:1,A项错误;B、偏铝酸钠溶液中加入盐酸,先发生反应AlO2-+H++H2O=Al(OH)3↓,生成Al(OH)3沉淀,当偏铝酸钠溶液反应完后,再继续加入盐酸发生反应Al(OH)3+3H+=Al3++3H2O,沉淀消失,前后两个过程HCl的物质的量之比为1:3,B项错误;C、氯化铝溶液中加入氢氧化钠溶液中,先发生反应Al3++3OH-=Al(OH)3↓,生成Al(OH)3沉淀,当氯化铝溶液反应完后,再滴入氢氧化钠溶液发生反应Al(OH)3+NaOH=NaAlO2+2H2O沉淀溶解至最后消失,前后两个过程氢氧化钠的物质的量之比为3:1,C项正确;D.氢氧化钠溶液中滴入氯化铝溶液,先发生反应Al3++4OH-═AlO2-+2H2O,不生成沉淀,当氢氧化钠溶液反应完后,再滴入氯化铝溶液发生反应后发生AlO2-+ Al3++6H2O=4Al(OH)3↓+6H2O,生成沉淀,前后两个过程氯化铝的物质的量之比为3:1,D项错误;答案选B。


科目:高中化学 来源: 题型:
【题目】下列反应属于吸热反应的是( )
A.乙醇的燃烧B.盐酸和氢氧化钠的中和反应
C.Ba(OH)2·8H2O与NH4Cl反应D.锌粒与稀H2SO4反应制取H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,由酸(HM)及其盐(NaM)组成的混合溶液,起始浓度均为lmol·L-1。向该溶液中通入HC1气体或加入NaOH固体时,溶液pH的变化曲线如图所示。下列说法不正确的是

A. C点时,溶液中 c(Na+)=c(M-)
B. 将 D、E 点溶液混合后,c(M-)+c(HM)=2c(Na+)
C. B点时,溶液中 c(M-)>c(Na+)>c(HM)
D. A、B、C三点所表示的溶液中水电离出来的c(H+)逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质中:A.KI(s) B.C2H5OH(l) C.Cl2(g) D.CH3COOH(l) E.BaSO4(s) F.NaHSO4(s) G.石墨(s) H.蔗糖(s) I.NaOH(l)
属于非电解质的是_________,属于强电解质的是_________,能直接导电的是____________________,能溶于水,且水溶液能导电的是________________。
(2)将6g CH3COOH溶于水制成1L溶液,此溶液的物质的量浓度为________,经测定溶液中含CH3COO-为1.4×10-3mol/L,此温度下醋酸的电离常数:Ka=____________,温度升高Ka将____________(填“变大”、“不变”或“变小”)。
(3)Al(OH)3的电离方程式可表示为:H++AlO![]() +H2O
+H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH-。试根据平衡移动原理,解释下列有关的问题。
Al3++3OH-。试根据平衡移动原理,解释下列有关的问题。
a、向Al(OH)3沉淀中加入盐酸,沉淀溶解,其原因是_______________________,有关的离子方程式为________________________________。
b、向Al(OH)3沉淀中加入苛性钠溶液,沉淀溶解,其原因是_____________________,有关的离子方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Na2CO3和NaHCO3比较中,下列说法不正确的是
A. NaHCO3固体受热容易分解,而Na2CO3固体受热不容易分解
B. 等质量的Na2CO3和NaHCO3分别与足量的盐酸反应,前者消耗盐酸的物质的量比后者多
C. 等物质的量浓度的Na2CO3和NaHCO3溶液分别滴加2滴酚酞试液,前者颜色比后者深
D. Na2CO3溶液和NaHCO3溶液分别与Ba(OH)2溶液反应的离子方程式相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2回收资源化利用是环保领域研宄的热点课题,
(1)在FeO催化下,以CO2为原料制取炭黑(C)的太阳能工艺如图1所示。
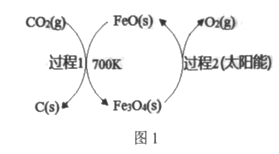
己知:①过程1生成lmolC(s)的反应热为△H1。
②过程2反应:Fe3O4(s)![]() 3FeO(s)+l/2O2(g) △H2。
3FeO(s)+l/2O2(g) △H2。
上述以CO2为原料制取炭黑总反应的热化学方程式为____________,若该反应的△S<0,请判断
该反应是否为自发反应并说明理由___________________。
(2)以CO2为原料可以催化加氢合成低碳烯烃,利用CO2合成乙烯的反应方程式为:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g) △H3。在常压下,以 FeCoMnK/BeO 作催化剂,按n(CO2): n(H2)=l:3(总物质的量为4amol)的投料比充入密闭容器中发生反应。测得温度对CO2的平衡转化率和催化剂催化效率影响情况如图2所示。
C2H4(g)+4H2O(g) △H3。在常压下,以 FeCoMnK/BeO 作催化剂,按n(CO2): n(H2)=l:3(总物质的量为4amol)的投料比充入密闭容器中发生反应。测得温度对CO2的平衡转化率和催化剂催化效率影响情况如图2所示。

①下列说法不正确的是______________。
A. △H3<0;平衡常数:KM >KN
B.增加原催化剂的表面积,对平衡转化率无影响
C.生成乙烯的速率:v(M)有可能小于v(N)
D.若投料比改为n(CO2):n(H2)=1:2,可以提高CO2的平衡转化率
E.若投料比不变,温度越低,反应一定时间后CO2的转化率越高
②250℃下,上述反应达平衡时容器体积为VL,则此温度下该反应的平衡常数为___________(用含a、V的代数式表示)。
③某温度下,n(C2H4)随时间(t)的变化趋势曲线如图3所示。其它条件相同时,若容器的体积为其一半,画出0~t1时刻n(C2H4)随时间(t)的变化趋势曲线。______
(3)以稀硫酸为电解质溶液,利用太阳能可将CO2电解转化为低碳烯烃,则电解生成丙烯时,阴极的电极反应为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)完成下列表格
主要物质 | 杂质 | 除杂试剂 | 操作名称 |
CO2气体 | HCl气体 | _______ | _______ |
FeCl2溶液 | CuCl2 | _______ | _______ |
水 | 花生油 | _______ |
(2)用双线桥法表述(只标注电子转移情况):MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O___________。
MnCl2+Cl2↑+2H2O___________。
用单线桥法表述电子转移情况:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O___________。
(3)用所给量的符号和必要的数据,按要求列出相关计算式:
①摩尔质量为M,气体摩尔体积为Vm,则气体体积V与气体质量m的关系___________。
②物质的量浓度为c,溶质摩尔质量为M,则溶液体积V与所含溶质质量m的关系____。
③溶质摩尔质量为M,溶液密度为dg/ml,则物质的量浓度c与溶质质量分数a%的关系c=__。
④摩尔质量为M,气体摩尔体积为Vm,则气体的密度=______________。
⑤某条件下气体摩尔体积为Vm,将V升某气体(摩尔质量为M)溶于1升水,得到密度为dg/mL的溶液,则该溶液的物质的量浓度c=_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com