
【题目】实验室中欲分离乙酸乙酯、乙酸、乙醇的混合物,如图是分离操作流程图 ( )

A. ①蒸馏 ②过滤 ③分液 B. ①分液 ②蒸馏 ③结晶
C. ①蒸馏 ②分液 ③分液 D. ①分液 ②蒸馏 ③蒸馏
科目:高中化学 来源: 题型:
【题目】下列各组中两个化学反应,属于同一反应类型的一组是
A. 由苯制溴苯;由乙醇与乙酸反应制乙酸乙酯
B. 由乙烯制1,2-二溴乙烷;由乙烷制一氯乙烷
C. 乙烯使溴水褪色;乙烯使酸性高锰酸钾溶液褪色
D. 由苯制硝基苯;由苯制环己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是______________和________________(填分子式)。
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。已知:O3的起始浓度为0.0216 mol/L。
T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
50 | 31 | 26 | 15 | 7 |
①pH增大能加速O3分解,表明对O3分解起催化作用的是________。
②在30 ℃、pH=4.0条件下,O3的分解速率为________mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________(填字母代号)。
a.40 ℃、pH=3.0
b.10 ℃、pH=4.0
c.30 ℃、pH=7.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质。请回答:
(1)甲烷的电子式为 ______________,空间构型为_____________。
(2)下列可以鉴别甲烷和乙烯的试剂为________(填选项字母)。
A.稀硫酸 B.溴的四氯化碳溶液
C.水 D.酸性高锰酸钾溶液
(3)写出下列化学方程式,并指出反应类型:
CH4与Cl2光照生成CH3Cl_____________________________,反应类型________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫、二氧化碳、三氧化硫同时具备的性质是( )
A.都能使品红试液褪色
B.都能和氢氧化钠溶液反应生成盐和水
C.都有刺激性气味
D.常温下都是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
A.H+、NO3﹣、Fe2+、Na+
B.Ag+、NO3﹣、Cl﹣、K+
C.K+、Ba2+、OH﹣、SO42﹣
D.Cu2+、NH4+、Br﹣、OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示化学过程的化学用语书写正确的是
A. BaSO4投入水中后建立的沉淀溶解平衡:BaSO4![]() Ba2++SO42-
Ba2++SO42-
B. AlCl3溶液与NaAlO2溶液混合:A13++A1O2-+3H2O![]() 2Al(OH)3↓
2Al(OH)3↓
C. HCO3-的电离:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
D. Na2SO3的水解:SO32-+2H2O![]() H2SO3+2OH-
H2SO3+2OH-
【答案】C
【解析】选项A的平衡应该标注各物质的状态,即为:BaSO4(s)![]() Ba2+(aq)+SO42-(aq),选项A错误。选项B的电荷不守恒,应该为A13++3A1O2-+6H2O
Ba2+(aq)+SO42-(aq),选项A错误。选项B的电荷不守恒,应该为A13++3A1O2-+6H2O![]() 4Al(OH)3↓,选项B错误。将选项C的方程式两边各去掉一个水分子,即得到:HCO3-
4Al(OH)3↓,选项B错误。将选项C的方程式两边各去掉一个水分子,即得到:HCO3-![]() CO32-+H+,表示的是碳酸氢根的电离,选项C正确。亚硫酸根离子的水解应该分步进行,选项D错误。
CO32-+H+,表示的是碳酸氢根的电离,选项C正确。亚硫酸根离子的水解应该分步进行,选项D错误。
【题型】单选题
【结束】
17
【题目】下列生活中的化学现象解释不正确的是
A. 生石灰可作食品速热剂是利用原电池原理
B. 泡沫灭火器是运用双水解原理产生CO2
C. 铝盐可作净水剂是利用铝离子水解产生胶体
D. 将煤气中毒的人移到通风处,是运用平衡理论
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率明显有效的是( )
A.Na与无水乙醇反应时增大无水乙醇的用量
B.Zn与25%的稀硫酸反应制取H2时,改用98%的浓硫酸
C.在K2SO4与BaCl2两溶液反应时,增大压强
D.将炭块磨成炭粉用于燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,将1.0L c molL-1CH3COOH溶液与0.1molNaOH固体混合,使之充分反应。然后向该混合溶液中加入少量CH3COOH或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示。下列叙述错误的是
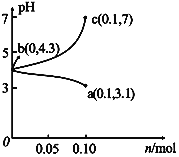
A. 水的电离程度:c>b>a
B. a点对应的混合溶液中,c(CH3COOH)>c(Na+ )>c(OH-)
C. 当混合溶液呈中性时,c(Na+ )=c(CH3COO-)>c(H+) =c(OH-)
D. 该温度下,醋酸的电离平衡常数![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com