
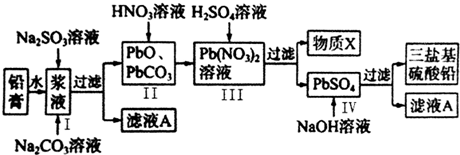
���� ��1��Ǧ���س��ʱ��������ʧ���ӷ���������Ӧ��
��2���ֵ���ǿ��Ϊ0.5A����ع���10���ӣ������Ϊ0.5A��600s=300C��ת�Ƶ��ӵ����ʵ���=$\frac{300C}{96500C/mol}$������Pb��ת�Ƶ���֮��Ĺ�ϵʽ��������Pb��������
��3����Ǧ�ཬҺ�м���Na2SO3��Һ��Ŀ���ǽ�PbO2��ԭPbO�������ķ�ӦΪNa2SO3+PbO2=PbO+Na2SO4����Na2CO3��Һ�ǽ�PbSO4ת����PbCO3��������Һ����Ҫ��Na2SO4��Һ��PbO��PbCO3�������������ת����Pb��NO3��2��Pb��NO3��2�м�ϡH2SO4ת����PbSO4�����ᣬ���XΪHNO3����ѭ�����ã��������˵�����BaSO4������ͨ�������Ƿ�����SO42-��
�ٸ÷�Ӧ��SԪ�ػ��ϼ���+4�۱�Ϊ+6�ۡ�PbԪ�ػ��ϼ���+4�۱�Ϊ+2�ۣ�ת�Ƶ�����Ϊ2����ϵ���غ��ԭ���غ���ƽ����ʽ��
������X����ѭ�����ã����������������Һ�л�ȡ����IJ�������������Ũ������ȴ�ᾧ�����˵ȣ����һ�ι���֮����Ҫϴ�ӣ��������λ�����Ǧ�Ƿ�ϴ��ʵ�����Ǽ�����������ӣ�
��PbSO4������ˮ������ֹ��һ����Ӧ��
�ܸ���CԪ���غ����̼��Ǧ�����ʵ���������PbԪ���غ㣬����PbO��̼��Ǧ�����ʵ������ݴ˼���PbO�����ʵ�������������������������
��� �⣺��1��Ǧ���س��ʱ��������ʧ���ӷ���������Ӧ���缫��ӦʽΪPbSO4+2H2O-2e-=PbO2+4H++SO42-���ʴ�Ϊ��PbSO4+2H2O-2e-=PbO2+4H++SO42-��
��2���ֵ���ǿ��Ϊ0.5A����ع���10���ӣ������Ϊ0.5A��600s=300C��ת�Ƶ��ӵ����ʵ���=$\frac{300C}{96500C/mol}$������Pb������=$\frac{300C}{96500C/mol}$��$\frac{1}{2}$��207g/mol=0.32g���ʴ�Ϊ��0.32��
��3����Ǧ�ཬҺ�м���Na2SO3��Һ��Ŀ���ǽ�PbO2��ԭPbO�������ķ�ӦΪNa2SO3+PbO2=PbO+Na2SO4����Na2CO3��Һ�ǽ�PbSO4ת����PbCO3��������Һ����Ҫ��Na2SO4��Һ��PbO��PbCO3�������������ת����Pb��NO3��2��Pb��NO3��2�м�ϡH2SO4ת����PbSO4�����ᣬ���XΪHNO3����ѭ�����ã��������˵�����BaSO4������ͨ�������Ƿ�����SO42-��
�ٸ÷�Ӧ��SԪ�ػ��ϼ���+4�۱�Ϊ+6�ۡ�PbԪ�ػ��ϼ���+4�۱�Ϊ+2�ۣ�ת�Ƶ�����Ϊ2����ϵ���غ��ԭ���غ���ƽ����ʽΪPbO2+SO32-+CO32-+H2O=PbCO3+SO42-+2OH-���ʴ�Ϊ��1��1��1��1��H2O��1��1��2��
������X����ѭ�����ã���������HNO3������Һ�л�ȡ����IJ�������������Ũ������ȴ�ᾧ�����˵ȣ����һ�ι���֮����Ҫϴ�ӣ��������λ�����Ǧ�Ƿ�ϴ��ʵ�����Ǽ�����������ӣ���������Ӽ��鷽��Ϊ��ȡ���һ��ϴ��Һ����������ϡ���ᣬ�ټ����Ȼ�����Һ���۲��Ƿ������ɫ��������������˵���Ѿ�ϴ�Ӹɾ���
�ʴ�Ϊ��HNO3������Ũ������ȴ�ᾧ��ȡ���һ��ϴ��Һ����������ϡ���ᣬ�ټ����Ȼ�����Һ���۲��Ƿ������ɫ��������������˵���Ѿ�ϴ�Ӹɾ���
�����ɵ�����Ǧ������ˮ�������ڹ���PbO��PbCO3�ı��棬�谭��Ӧ�Ľ�һ���������ʴ�Ϊ��PbSO4������ˮ�������ڹ�������谭��Ӧ�Ľ�һ��������
��PbO��̼��Ǧ�м������ᣬ���Եõ�����Ǧ��Һ��ͬʱ�ų�������̼���壬���ռ���5.6L��0.25molCO2����״̬��������̼Ԫ���غ㣬���Ժ���̼��Ǧ��0.25mol�����90.9g��0.3molPbSO4������Pb�غ㣬��ЩPb������PbO��̼��Ǧ������PbO�����ʵ�����0.3mol-0.25mol=0.05mol��PbO����������Ϊ$\frac{233g/mol��0.05mol}{78g}$��100%=14.3%��
�ʴ�Ϊ��14.3%��
���� ���⿼�������Ʊ���������Դ���͵�أ�Ϊ��Ƶ���㣬�漰���ʷ����ᴿ����ѧ����ʽ�ļ��㡢���Ӽ��顢������ԭ��Ӧ����ʽ��ƽ��֪ʶ�㣬��ȷ����ͼ�з����ķ�Ӧ���������������ǽⱾ��ؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ܢ٢ڢۢ� | B�� | �ܢۢ٢ڢ� | C�� | �ݢܢۢڢ� | D�� | �ڢۢ٢ܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Fe�Ļ�̬ԭ����Χ�����Ų�ͼ�� | |
| B�� | �Ȼ��Ƶķ���ʽ��NaCl | |
| C�� | N�Ļ�̬ԭ�Ӻ�������Ų�ʽ��lS22S22p3 | |
| D�� | HC10�Ľṹʽ��H-O-Cl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | x=4 | B�� | ƽ��������Ӧ�����ƶ� | ||
| C�� | B��ת���ʽ��� | D�� | C������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
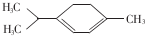 �������ǿ�ű��Чҩ������������ͼ��ʾ�л���Ҳ�������������л����һ��ȡ�����У����������칹����������
�������ǿ�ű��Чҩ������������ͼ��ʾ�л���Ҳ�������������л����һ��ȡ�����У����������칹����������| A�� | 5�� | B�� | 6�� | C�� | 7�� | D�� | 8�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
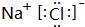 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com