
【题目】下列说法正确的是( )
A.漂白粉、液氯、干冰均为混合物 B.16O和18O互为同位素
C.稀硫酸、氨水均为电解质 D.溶于水能电离出H+的物质一定是酸
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物。以氟碳铈矿(主要含CeFCO3)为原料制备CeO2的一种工艺流程如下:
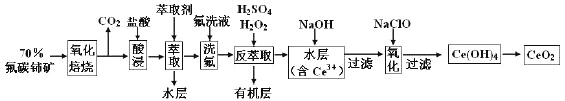
已知:①Ce4+既能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是__________________________。
(2)“酸浸”中会产生大量黄绿色气体,写出CeO2与盐酸反应的离子方程式:_________________________________;为避免产生上述污染,请提出一种解决方案:________。
(3)“萃取”时存在反应:Ce4++n(HA)2 ![]() Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为___________; ____________________________________________________________。
Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为___________; ____________________________________________________________。
(4)“反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+,H2O2在该反应中作_________(填“催化剂”、“氧化剂”或“还原剂”),每有1mol H2O2参加反应,转移电子的物质的量为________________。
(5)“氧化”步骤的化学方程式为________________________________。
(6)取上述流程中得到的CeO2产品0.4500g,加硫酸溶解后,用0.1000mol/LFeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其它杂质均不反应),消耗25.00mL标准溶液。该产品中CeO2的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa、25℃时,16 gN2H4在氧气中完全燃烧生成氮气,放出热量312 kJ。N2H4完全燃烧反应的热化学方程式是 。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时:正极的电极反应式是 。负极的电极反应方程式是 。
(3)下图是一个电化学过程示意图。

① 锌片上发生的电极反应方程式是 。
② 假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是 。
(5)将0.3 mol AgNO3、0.4 mol Cu(NO3)2和0.1mol KCl溶于水配成100 mL溶液,用惰性电极电解一段时间后,当阴极生成0.1mol气体时,此时,另一极上的气体体积(标准状况)为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰是燃煤电厂的废渣,主要成分为SiO2、Al2O3、Fe2O3和C等。实验室模拟工业从粉煤灰提取活性Al2O3,其流程如下图:

已知烧结过程的产物主要是:NaAlO2、Ca2SiO4、NaFeO2和Na2SiO3等。
(1)写出烧结过程中铝元素转化的化学方程式 。
(2)操作a为冷却、研磨,其中研磨的目的是 。
(3)浸出过程中,NaFeO2可完全水解,水解反应的离子方程式为 。
(4)操作b的名称是 ,所用的玻璃仪器有 、 和烧杯。
(5)“碳化”时生成沉淀,沉淀的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关非金属元素说法正确的是
A.二氧化氯具有还原性,可用于自来水的杀菌消毒
B.SO2具有氧化性,可用于漂白纸浆
C.液氨汽化时要吸收大量的热,可用作制冷剂
D.硅是重要的半导体材料,常用于制作光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质:①FeCl3;②Fe2O3;③Cu(NO3)2;④KCl,铜粉溶解的是( )
A.只有①或② B.只有①或②或④
C.只有①或②或③ D.上述任意一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中能大量共存的一组离子是( )
A.Pb2+、Hg2+、S2-、SO42- B.Na+、Ba2+、Cl-、NO3-
C.H+、Na+、Fe2+、MnO4- D.ClO-、Al3+、Br-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 “摩尔盐”[(NH4)2Fe(SO4)2·6H2O]是分析化学中的重要试剂。已知:摩尔盐隔绝空气加热至500 ℃时可完全分解。某学习小组欲探究其分解产物。
(1)【提出猜想】小组同学认为分解产物可能有以下几种情况:
A.Fe2O3 SO2 NH3 H2O
B.FeO SO3 NH3 H2O
C.FeO SO2 NH3 H2O
D.Fe2O3 SO3 SO2 NH3 H2O
根据所学知识,可确定________不成立(填序号)。
(2)【药品验纯】甲同学提出可以用湿润的红色石蕊试纸、稀盐酸和________溶液检验出“摩尔盐”中的三种离子;取一定量的“摩尔盐”配成溶液,取少量溶液置于试管中,向其中滴加________(填试剂名称和实验现象),则“摩尔盐”未因氧化而变质。
(3)【实验探究】为检验分解产物,甲同学设计了如下实验装置。
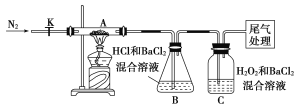
①取一定量“摩尔盐”置于加热管A中,加热至分解完全后打开K,再通入N2,目的是____________________。
②实验中观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀。C中发生反应的离子方程式为______________________。
③实验验证:取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含______________________。
(4)【实验结论与反思】通过实验现象和认真反思,上述(1)猜想中一定正确的是________(填序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com