
【题目】(I)如图是用于简单有机化合物的制备、分离、性质比较等的常见简易装置。请根据该装置回答下列问题:
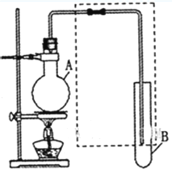
(1)若用乙醇与乙酸反应制取乙酸乙酯,则烧瓶A中加入的试剂在混合时的操作方法是___________,反应的化学方程式为___________,试管B中应加入___________。虚线框中的导管除用于导气外,还兼有___________作用。
(2)若用该装置分离乙酸和1-丙醇,则在烧瓶A中除加入1-丙醇与乙酸外,还应先加入适量的试剂___________,加热到一定温度,试管B中收集到的是(填写化学式)___________。冷却后,再向烧瓶中加入试剂___________再加热到一定温度,试管B中收集到的是___________(填写化学式)。
(3)若用该装置(不用加热)证明酸性:醋酸>碳酸>苯酚,则在烧瓶A中加入___________,试管B中应加入___________。
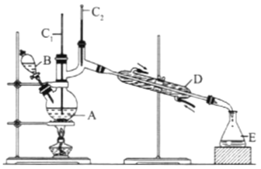
(II)正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛,发生:CH3CH2CH2CH2OH→![]() CH3CH2CH2CHO。
CH3CH2CH2CHO。
反应物和产物的相关数据列表:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 11.72 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由:__________。
(2)加入沸石的作用是__________;若加热后发现未加沸石,应采取的正确方法是__________。
(3)上述装置图中,B仪器的名称是__________,D仪器的名称是__________。
(4)分液漏斗使用前必须进行的操作是(填字母)__________。
A.润湿 B.干燥 C.检漏 D.标定
(5)将正丁醛粗产品置于分液漏斗中分液时,水在__________层(填“上”,或“下”)。
(6)反应温度应保持在90~95℃,其原因是__________。
(7)本实验中,正丁醛的产率为__________%。.
【答案】先加入一定量的乙醇,然后边摇动烧瓶边慢慢加入一定量的浓硫酸,冷却后再加乙酸 CH3COOH+C2H5OH![]() CH3COOCH2CH3+H2O 饱和碳酸钠溶液 冷凝 生石灰 CH3CH2CH2OH 浓硫酸 CH3COOH(其他答案合理) 碳酸钠和醋酸 苯酚钠溶液 不能,易迸溅 防止暴沸 冷却后补加 分液漏斗 直形冷凝管 C 下 既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化 51.3
CH3COOCH2CH3+H2O 饱和碳酸钠溶液 冷凝 生石灰 CH3CH2CH2OH 浓硫酸 CH3COOH(其他答案合理) 碳酸钠和醋酸 苯酚钠溶液 不能,易迸溅 防止暴沸 冷却后补加 分液漏斗 直形冷凝管 C 下 既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化 51.3
【解析】
(I)(1)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水;
(2)乙酸和1-丙醇混合形成恒沸液,分离乙酸和1-丙醇时,应先将乙酸转化为离子化合物,形成沸点差异,再蒸馏;
(3)应用强酸制弱酸的原理设计实验;
(II)(1)Na2Cr2O7溶液和浓硫酸混合时相当于浓硫酸的稀释;
(2)沸石能防止溶液暴沸,若加热后发现未加沸石,应该冷却后补加,不能直接加入沸石;
(3)B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管;
(4)含有活塞的仪器使用前必须检漏,分液漏斗中含有活塞,所以使用前必须检漏;
(5)分液时,密度小的液体位于上方,密度大于的液体位于下方;
(6)根据题目所给反应物和产物的沸点数据可知,反应温度保持在90~95℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化;
(7)由题给数据和公式计算可得。
(I)(1)为防止酸液飞溅,应将密度大的液体加入到密度小的液体中,乙酸易挥发,冷却后再加入乙酸;酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,反应的化学方程式为:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;生成的乙酸乙酯蒸汽中含有乙醇和乙酸,要用饱和碳酸钠溶液分离混合物;长导管起到导气和冷凝乙酸丙酯蒸汽的作用,故答案为:先加入乙醇,然后边摇动烧瓶边慢慢加入浓硫酸,冷却后再加乙酸;CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O;生成的乙酸乙酯蒸汽中含有乙醇和乙酸,要用饱和碳酸钠溶液分离混合物;长导管起到导气和冷凝乙酸丙酯蒸汽的作用,故答案为:先加入乙醇,然后边摇动烧瓶边慢慢加入浓硫酸,冷却后再加乙酸;CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;饱和碳酸钠溶液;冷凝;
CH3COOCH2CH3+H2O;饱和碳酸钠溶液;冷凝;
(2)乙酸和1-丙醇混合形成恒沸液,分离乙酸和1-丙醇时,应先在乙酸和1-丙醇的混合液中加入CaO,把乙酸转化为盐溶液,加热蒸馏,试管B中收集到的馏分为丙醇,烧瓶中剩余的为乙酸钙的水溶液,再加浓硫酸得到乙酸,通过蒸馏分离得到乙酸,故答案为:CaO;CH3CH2CH2OH;浓硫酸;CH3COOH;
(3)若要证明酸性:醋酸>碳酸>苯酚,应在烧瓶A中加入苯酚钠和醋酸,有气泡产生,说明反应生成二氧化碳气体,证明酸性:醋酸>碳酸;将生成的二氧化碳通入盛有苯酚钠溶液试管B中,溶液变浑浊,证明酸性:碳酸>苯酚,故答案为:碳酸钠和醋酸;苯酚钠溶液;
(II)(1)Na2Cr2O7溶液和浓硫酸混合时相当于浓硫酸的稀释,应该将浓硫酸倒入Na2Cr2O7溶液,不能将Na2Cr2O7溶液加到浓硫酸中,因为浓硫酸的密度大,容易发生迸溅,故答案为:不能,易迸溅;
(2)沸石能防止溶液暴沸,若加热后发现未加沸石,应该冷却后补加,不能直接加入沸石,
故答案为:防止暴沸;冷却后补加;
(3)B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管,故答案为:分液漏斗;直形冷凝管;
(4)含有活塞的仪器使用前必须检漏,分液漏斗中含有活塞,所以使用前必须检漏,故答案为:C;
(5)分液时,密度小的液体位于上方,密度大于的液体位于下方,正丁醛密度小于水,所以水位于下方,故答案为:下;
(6)根据题目所给反应物和产物的沸点数据可知,反应温度保持在90~95℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化,故答案为:保证正丁醛及时蒸出,又可尽量避免其被进一步氧化;
(7)设正丁醛的产率为x,则正丁醇的利用率为x,根据关系式C4H10O~C4H8O可得74:72=4xg:2g,解得x=![]() ×100%=51.3%,故答案为:51.3。
×100%=51.3%,故答案为:51.3。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】I.自然界中的物质绝大多数以混合物的形式存在,为了便于研究和利用,常需对混合物进行分离和提纯。下列A、B、C、D是中学常见的混合物分离或提纯的装置。
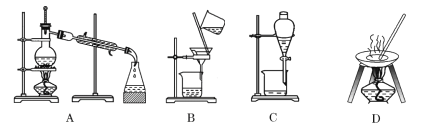
请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D 填入适当的空格中。
(1)碳酸钙悬浊液中分离出碳酸钙__________;
(2)氯化钠溶液中分离出氯化钠___________;
(3)分离39%的乙醇溶液___________;
(4)分离溴的氯化钠溶液____________;
Ⅱ.利用“化学计量在实验中的应用”的相关知识进行填空
已知某饱和氯化钠溶液体积为VmL,溶液密度为d g/cm3,质量分数为w,物质的量浓度为c mol/L,溶液中含NaCl的质量为m g。
(1)用m、V表示溶液的物质的量浓度是_________
(2)用w、d表示溶液的物质的量浓度是_________
(3)用c、d表示溶液的质量分数是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁酸钾晶体{K3[Fe(C2O4)3]·3H2O}易溶于水,难溶于乙醇,可用于摄影和蓝色印刷。三草酸合铁酸钾晶体在110 ℃可完全失去结晶水,继续升高温度可发生分解反应。
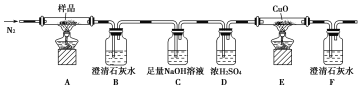
(1)分解得到的气体产物用如下装置进行实验:
检查装置气密性后,先通一段时间的N2,其目的是________________;结束实验时,先熄灭酒精灯再通入N2至常温。实验过程中观察到B、F中澄清石灰水都变浑浊,E中有红色固体生成,则分解得到的气体产物是________。
(2)分解得到的固体产物含有K2CO3、FeO、Fe,加水溶解、过滤、洗涤、干燥,得到含铁样品。现设计下列两种实验方案对该样品进行铁元素含量测定:
(甲)a g样品![]() 溶液
溶液![]()
![]() 得固体b g
得固体b g
(乙)a g样品![]() 配制250 mL溶液
配制250 mL溶液![]() 三次平均消耗0.1 mol·L-1酸性KMnO4溶液V mL。
三次平均消耗0.1 mol·L-1酸性KMnO4溶液V mL。
你认为以上________(填“甲”或“乙”)方案可确定样品的组成,测得铁元素的含量是________,不可确定样品组成的方案的理由是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌银电池的负极为锌,正极为氧化银,电解质是KOH,电池反应为Zn+Ag2O+H2O![]() Zn(OH)2+2Ag。以锌银电池为电源,电解硫酸镍溶液冶炼纯镍,装置如图所示。
Zn(OH)2+2Ag。以锌银电池为电源,电解硫酸镍溶液冶炼纯镍,装置如图所示。
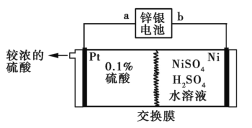
下列说法正确的是
A.装置中使用阳离子交换膜
B.锌银电池a极反应式为Ag2O+H2O+2e-![]() 2Ag+2OH-
2Ag+2OH-
C.镍极的主要反应为2H++2e-![]() H2↑
H2↑
D.若锌银电池溶解13 g锌,则镍极净增质量最多为5.9 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散。下列判断正确的是( )
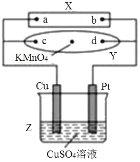
A.滤纸上c点附近会变红色
B.Cu电极质量减小,Pt电极质量增大
C.Z中溶液的pH先减小,后增大
D.溶液中的SO42-向Cu电极定向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在稀溶液里,强酸跟强碱发生中和反应生成1 mol液态水时反应热叫做中和热。现利用下图装置进行中和热的测定,请回答下列问题:
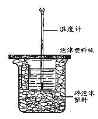
(1)图中未画出的实验器材是______________。
(2)烧杯间填满碎纸条的作用是 ___________________________。
(3)实验时,将0.50 mol·L-1的盐酸加入到0.55mol·L-1的NaOH溶液中,两种溶液的体积均为50 mL,各溶液的密度均为1 g /cm3,生成溶液的比热容c=4.18 J /(g· oC),实验的起始温度为t1 oC,终止温度为t2 oC。测得温度变化数据如下:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
①试计算上述实验测出的中和热ΔH1=______________。
②如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等、不相等”),所求中和热__________(填“相等、不相等”)
③如用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将____(填“偏大”、“偏小”、“不变”) , 其理由是___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO可用于合成甲醇,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
(1)如图是反应CO(g)+2H2(g)![]() CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
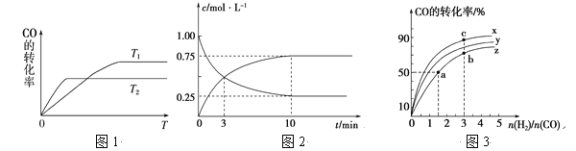
①该反应的焓变ΔH________0 (填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______ K2 (填“>”、“<”或“=”)。在T1温度下,往体积为1 L的密闭容器中,充入1 mol CO和2 mol H2,经测得CO和CH3OH(g)的浓度随时间变化如图所示。则该反应的平衡常数为______________。
③若容器容积不变,下列措施可增加CO转化率的是________(填字母)。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2)在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线z对应的温度是________℃;曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷属于同一主族元素,是组成生命体的重要元素,其单质及化合物用途广泛。回答下列问题:
(1)基态P原子的核外电子排布式为___________________
(2)自然固氮现象发生的一系列化学变化:![]() ,解释了民谚“雷雨发庄稼”的原理。
,解释了民谚“雷雨发庄稼”的原理。
①![]() 分子结构中σ键和π键数目之比为__________
分子结构中σ键和π键数目之比为__________
②![]() 中N原子采取__________杂化方式,写出它的一种等电子体的化学式:__________。
中N原子采取__________杂化方式,写出它的一种等电子体的化学式:__________。
③已知酸性:![]() ,下列相关见解合理的是__________。
,下列相关见解合理的是__________。
A.含氧酸中氧原子总数越多,酸性越强
B.同种元素化合价越高,对应含氧酸的酸性越强
C.![]() 中氮元素的正电性更高,在水溶液中更易电离出
中氮元素的正电性更高,在水溶液中更易电离出![]() ,酸性强于
,酸性强于![]()
(3)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如图所示,图中a点和b点的原子坐标参数分别为(0,0,0)、![]() ,则c点的原子坐标参数为__________。已知该晶体密度为
,则c点的原子坐标参数为__________。已知该晶体密度为![]() ,则B—P键的键长为__________pm(阿伏加德罗常数用
,则B—P键的键长为__________pm(阿伏加德罗常数用![]() 表示,列出计算式即可)。
表示,列出计算式即可)。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如下图所示装置来制备乙炔,并验证乙炔的某些化学性质,制备的 乙炔气体中往往含有少量的 H2S 和PH3气体,请按下列要求填空:

(1)实验室制乙炔的化学方程式是:_________________;为了得到较为平稳的乙炔气流, 装置 A 的分液漏斗中常用______________来代替水.
(2) 装置 D 中观察到的现象是 ___________________________________________
(3) 装置 B 中CuSO4溶液的作用是_______________________________.
(4)写出以乙炔和HCl为原料,合成聚氯乙烯的方程式是________________,___________________ 。
(5)若称取m g 电石,反应完全后,生成的乙炔n g,则CaC2的纯度为_____(用m与n表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com