
【题目】已知在稀溶液里,强酸跟强碱发生中和反应生成1 mol液态水时反应热叫做中和热。现利用下图装置进行中和热的测定,请回答下列问题:
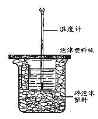
(1)图中未画出的实验器材是______________。
(2)烧杯间填满碎纸条的作用是 ___________________________。
(3)实验时,将0.50 mol·L-1的盐酸加入到0.55mol·L-1的NaOH溶液中,两种溶液的体积均为50 mL,各溶液的密度均为1 g /cm3,生成溶液的比热容c=4.18 J /(g· oC),实验的起始温度为t1 oC,终止温度为t2 oC。测得温度变化数据如下:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
①试计算上述实验测出的中和热ΔH1=______________。
②如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等、不相等”),所求中和热__________(填“相等、不相等”)
③如用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将____(填“偏大”、“偏小”、“不变”) , 其理由是___
【答案】环形玻璃搅拌棒 固定小烧杯,保温,减少实验过程中热量损失 56.85kJ/mol 不相等 相等 偏大 NaOH固体溶于水放出热量,中和热为正值,释放热量,导致数值增大
【解析】
(1)为加速酸碱中和反应,减少热量损失,图中缺少环形玻璃搅拌棒;
(2)碎纸条的作用是固定小烧杯,保温,减少实验过程中热量损失;
(3)实验1初始温度为![]() =20.25℃,温度变化为23.7-20.25=3.45℃;实验2初始温度为
=20.25℃,温度变化为23.7-20.25=3.45℃;实验2初始温度为![]() =20.4℃,温度变化为23.8-20.4=3.4℃;实验3初始温度为
=20.4℃,温度变化为23.8-20.4=3.4℃;实验3初始温度为![]() =21.55℃,温度变化为24.9-21.55=3.35℃;三次试验温差不大,数据均可用,平均值为=
=21.55℃,温度变化为24.9-21.55=3.35℃;三次试验温差不大,数据均可用,平均值为=![]() =3.4℃;
=3.4℃;
(1)为加速酸碱中和反应,减少热量损失,图中缺少环形玻璃搅拌棒;
(2)碎纸条的作用是固定小烧杯,保温,减少实验过程中热量损失;
(3)①Q=cmt=4.18 J /(g· oC)×100g×3.4℃=1.421kJ,则ΔH1=![]() =56.85kJ/mol;
=56.85kJ/mol;
②如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,生成水的量为0.0275mol,比原来增大,释放的热量增大;中和热为强酸与强碱的稀溶液生成1mol液态水时释放的热量,所求的中和热相等;
③如用0.5mol/L的盐酸与NaOH固体进行实验,NaOH固体溶于水放出热量,中和热为正值,释放热量,导致数值增大,则为偏大。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】氯苯是一种重要的有机合成原料,用氯苯合成染料中间体F的两条路线如下图所示。
路线1: 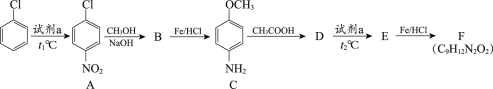
路线2: 
(1)试剂a为________。
(2)A→B的反应类型为取代反应,该反应的化学方程式为________。
(3)B→C的反应类型为________。
(4)C与CH3COOH的相对分子质量之和比D的相对分子质量大18,D→E的取代反应发生在甲氧基(—OCH3)的邻位,F的结构简式为________。
(5)G的结构简式为________。
(6)有机物I与对苯二甲酸(![]() )发生聚合反应的化学方程式为_____。
)发生聚合反应的化学方程式为_____。
(7)I与CH3COOH反应生成的有机产物除F外,还可能有________(写出结构简式)。
(8)满足下列条件的C的同分异构体有________种。①与FeCl3溶液发生显色反应②分子中含有—NH2③苯环上有3种氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接煤一空气燃料电池原理如图所示,下列说法错误的是( )
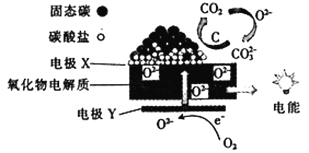
A. 随着反应的进行,氧化物电解质的量不断减少
B. 负极的电极反应式为C+2CO32--4e-=3CO2↑
C. 电极X为负极,O2-向X极迁移
D. 直接煤一空气燃料电池的能量效率比煤燃烧发电的能量效率高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
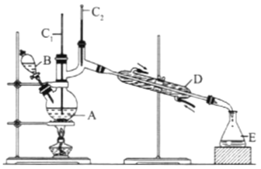
【题目】(I)如图是用于简单有机化合物的制备、分离、性质比较等的常见简易装置。请根据该装置回答下列问题:
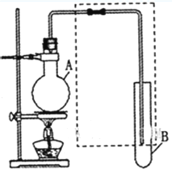
(1)若用乙醇与乙酸反应制取乙酸乙酯,则烧瓶A中加入的试剂在混合时的操作方法是___________,反应的化学方程式为___________,试管B中应加入___________。虚线框中的导管除用于导气外,还兼有___________作用。
(2)若用该装置分离乙酸和1-丙醇,则在烧瓶A中除加入1-丙醇与乙酸外,还应先加入适量的试剂___________,加热到一定温度,试管B中收集到的是(填写化学式)___________。冷却后,再向烧瓶中加入试剂___________再加热到一定温度,试管B中收集到的是___________(填写化学式)。
(3)若用该装置(不用加热)证明酸性:醋酸>碳酸>苯酚,则在烧瓶A中加入___________,试管B中应加入___________。
(II)正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛,发生:CH3CH2CH2CH2OH→![]() CH3CH2CH2CHO。
CH3CH2CH2CHO。
反应物和产物的相关数据列表:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 11.72 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由:__________。
(2)加入沸石的作用是__________;若加热后发现未加沸石,应采取的正确方法是__________。
(3)上述装置图中,B仪器的名称是__________,D仪器的名称是__________。
(4)分液漏斗使用前必须进行的操作是(填字母)__________。
A.润湿 B.干燥 C.检漏 D.标定
(5)将正丁醛粗产品置于分液漏斗中分液时,水在__________层(填“上”,或“下”)。
(6)反应温度应保持在90~95℃,其原因是__________。
(7)本实验中,正丁醛的产率为__________%。.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下的密闭容器中存在如下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
(1)当CO转化率为25%时,该反应是否达到平衡,若未达到,向哪个方向进行?
(2)达到平衡时,CO的转化率为多少?
(3)当CO的起始浓度仍为2mol·L-1,H2O(g)的起始浓度为6mol·L-1,求平衡时CO的转化率?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,下列研究目的和示意图相符的是( )
2NH3(g) ΔH<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响(p2>p1) | 温度对反应的影响 | 平衡体系中增加N2的浓度对反应的影响 | 催化剂对反应的影响 |
示意图 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁及其合金是用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:
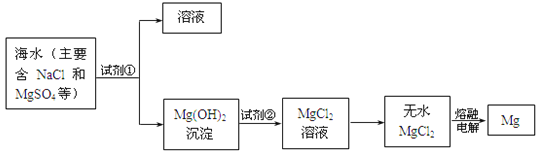
(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用_________;
(2)无水MgCl2在熔融状态下,通电后产生镁和氯气,该反应的化学方程式为__________________;
(3)电解后产生的副产物氯气可用于工业制漂白粉。某兴趣小组模拟工业制漂白粉,设计了下图的实验装置。
已知:①氯气和碱反应放出热量。②6Cl2+6Ca(OH)2![]() 5CaCl2+Ca(ClO3)2+6H2O
5CaCl2+Ca(ClO3)2+6H2O
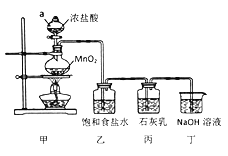
回答下列问题:
①甲装置中仪器a的名称是____________________;
②装置乙中饱和食盐水的作用是__________________________________;
③制取漂白粉的化学方程式是_____________________________________;
④该小组制得的漂白粉中n(CaCl2)远大于n(Ca(ClO)2],其主要原因是_________;
⑤为提高丙中Ca(ClO)2的含量,可采取的措施是_______________(任写一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】衣康酸M是制备高效除臭剂、粘合剂等多种精细化学品的重要原料,可经下列反应路线得到(部分反应条件已略)。

已知:①R-CH2-Cl + NaCN → R-CH2-CN + NaCl
②R-CH2-CN + NaOH + H2O → R-CH2-COONa + NH3
完成下列填空:
(1)A的结构简式是_____________,M中官能团的名称是________________,
(2)写出B→ C的化学反应方程式________________________________________。写出G的结构简式______________________________________
(3)反应a与反应b的先后顺序不能颠倒,解释原因:_________________________________________________________________________。
(4)写出由A和1,3—丁二烯1:1共聚所得高聚物的结构简式____________________________
(5)请设计由CH2=CHCH2OH 制备CH2=CHCOOH的合成路线(无机试剂任选)________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com