
【题目】下列物质中含有NA个氯化氢分子的是( )
A.将1mol H2和lmol Cl2光照或点燃后的产物
B.室温下22.4L的HCl气体
C.室温下,将1mol HCl气体通入100mL水中所得的液体
D.室温下,36.5g HCl气体
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 已知冰的熔化热为6.0kJ·mol-1,冰中氢键键能为20kJmol-1,假设每摩尔冰中有2mol氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键
B. 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a,Ka=(ca)2/c(1-a)。若加水稀释,,则CH3COOH![]() CH3COO-+H+向右移动,a增大,Ka不变
CH3COO-+H+向右移动,a增大,Ka不变
C. 甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1
D. 500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019 年是“国际化学元素周期表年”。 1869 年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下。下列说法中错误的是
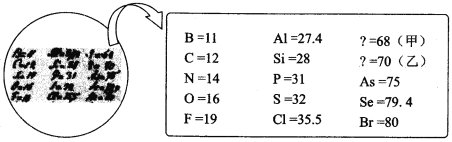
A. 甲位于现行元素周期表第四周期第ⅢA 族B. 原子半径比较:甲>乙> Si
C. 乙的简单气态氢化物的稳定性强于CH4D. 推测乙的单质可以用作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应①2H2O(l)![]() 2H2(g)+O2(g)+Q1和反应②2H2O(l)
2H2(g)+O2(g)+Q1和反应②2H2O(l)![]() 2H2(g)+O2(g)+Q2,都是分解得到H2和O2,下列判断错误的是( )
2H2(g)+O2(g)+Q2,都是分解得到H2和O2,下列判断错误的是( )
A. 反应①中太阳能转化为化学能B. 反应②中电能转化为化学能
C. Q1>0、Q2<0D. Q1=Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是构成矿物和岩石的主要成分,单质硅及其化合物具有广泛的用途。完成下列填空:
(1)某些硅酸盐具有筛选分子的功能。一种硅酸盐的组成为:M2O·R2O3·2SiO2·nH2O,已知元素M、R均位于元素周期表的第3周期,两元素原子的质子数之和为24。
①写出M原子核外能量最高的电子的电子排布式:___________。
②常温下,不能与R单质发生反应的是_______(选填序号)。
a.CuCl2溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)氮化硅(Si3N4)陶瓷材料硬度大、熔点高。可由下列反应制得:SiO2+C+N2![]() Si3N4+CO
Si3N4+CO
①Si3N4中氮元素的化合价为-3,请解释Si3N4中氮元素化合价为负价的原因__________________。
②C3N4的结构与Si3N4相似,请比较二者熔点高低,并说明理由:______________________。
③配平上述反应的化学方程式,并标出电子转移的数目和方向。_______________。
(3)一种用工业硅(含少量铁、铜等金属的氧化物)制备Si3N4的主要流程如下:

①将工业硅粉碎的目的是______________________________。
②适量的H2是为了排尽设备中的空气,但H2在高温下也能还原工业硅中的某些金属化物。![]() 可能是______(选填:“盐酸”“硝酸”或“硫酸”),理由是_____________________。
可能是______(选填:“盐酸”“硝酸”或“硫酸”),理由是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲利用如图装置制取能较长时间存在的Fe(OH)2,其中实验所用溶液现配现用且蒸馏水先加热煮沸。下列分析正确的是

A. X可以是稀硫酸或稀硝酸或稀盐酸
B. 实验开始时应先关闭止水夹a、打开b,再向烧瓶中加入X
C. 反应一段时间后可在烧瓶中观察到白色沉淀
D. 反应结束后若关闭b及分液漏斗活塞,则Fe(OH)2可较长时间存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:

常温下几种物质开始形成沉淀与完全沉淀时的pH如下表

(1)炉气中的有害气体成分是___________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为___________。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:______________________。当试剂X是___________时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是______________________。
(4)写出用N2H4制备Cu2O的化学方程式:______________________,操作X包括___________、洗涤、烘干,其中烘干时要隔绝空气,其目的是___________。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾与草酸的反应,记录以下实验数据:
实验编号 | 实验温度 | 试管中所加试剂及其用量 / mL | 溶液褪至无色所需时间/ min | |||
0.6mol/L H2C2O4 溶液 | H2O | 3mol/L H2SO4 稀溶液 | 0.05mol/L KMnO4溶液 | |||
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请写出该反应的离子方程式__________________________________________,当该反应以表中数据反应完全时转移电子数为_______________NA
(2)V1 ______
(3)根据上表中的实验①、②数据,可以得到的结论是_____。
(4)探究温度对化学反应速率的影响,应选择_____(填实验编号)
(5)该小组同学根据经验绘制了 n (Mn 2+ )随时间变化的趋势如图 1 所示,但有同学查阅已有的实验资料发现,该实验过程中 n (Mn 2+ ) 随时间变化的实际趋势如图 2 所示。

该小组同学根据图 2 所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再加入某种固体 | 溶液褪至无色所需时间 / min | |||
④ | 25 | 0.6mol/L H2C2O4 溶液 | H2O | 3mol/L H2SO4 稀溶液 | 0.05mol/L KMnO4 溶液 | ||
2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t | ||
①该小组同学提出的假设是_____。
②若该小组同学提出的假设成立,应观察到_________________________________现象。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍及其化合物的应用正日益被重视。
(l)最重要的含铍矿物是绿柱石,含2%铬(Cr)的绿柱石即为祖母绿。基态Cr原子价电子的轨道表示式为______________________________。
(2)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有_____(填标号)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.都能与氢氧化钠溶液反应
(3)铍、镁晶体都是由金属原子密置层在三维空间堆积而成(最密堆积)。铍的熔点比镁的熔点高,原因是_____________________________________________________。
(4)氯化铍在气态时存在BeC12分子(a)和二聚分子(BeCl2)2(b),固态时则具有如图所示的链状结构(c)。

①a属于_____“极性”或“非极性”)分子。
②b中Be原子的杂化方式相同,且所有原子都在同一平面上。b 的结构式为________(标出配位键)。
③c中Be原子的杂化方式为_____。
④氯化铍晶体中存在的作用力有_____(填标号)。
A.范德华力 B.σ键 C.极性键 D.非极性键 E.离子键
(5)BeO立方晶胞如图所示。

①BeO晶体中,O2﹣的配位数为_____。
②若BeO晶体的密度为dg/cm3,BeO的摩尔质量为Mg·mol-1,阿伏伽德罗常数为NA,则晶胞参数a=_______________ cm (列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com