
【题目】用相同体积的0.1mol· L-1的BaCl2溶液,能分别使相同体积的Fe2(SO4)3、ZnSO4、Na2SO4溶液的SO42-完全沉淀,则三种溶液的物质的量浓度之比为( )
A. 3∶2∶1 B. 1∶2∶3 C. 3∶1∶1 D. 1∶3∶3
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】I.如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液。回答下列问题:

锌为__极,该电极上发生__反应(“氧化”或“还原”),电极反应式为__,该原电池的总反应离子方程式为__.
II.(1)氮化钠的电子式是_____________。
(2)氮化钠与水反应的化学方程式是__________________。
(3)氮化钠与盐酸反应生成_______种盐。
(4)氮化钠中两种微粒的半径大小比较: r(Na+)___r(N3-)(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的说法一定正确的是( )
A. 用湿润的pH试纸测溶液的pH
B. 实验室制备干燥纯净的氯气时,气体先通过饱和食盐水再通过浓硫酸
C. 用玻璃棒在过滤器上搅拌以加速AgCl沉淀的洗涤
D. 中和滴定实验中,锥形瓶用蒸馏水洗净后未干燥,测定结果偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在一定条件下反应,可以制得较纯净一氯乙烷的是
A. 乙烷与氯气取代B. 乙烯与氯化氢加成
C. 乙烯与氯气加成D. 乙烯与氢气加成,再用氯气取代
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下,可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应。A.B.C都可以被强还原剂还原成为D(C6H14O6)。B脱水可得到五元环的酯类化合物E或六元环的酯类化合物F。

已知,相关物质被氧化的难易次序是:RCHO最易,R—CH2OH次之,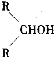 最难。请在下列空格中填写A.B.C.D.E、F的结构简式。
最难。请在下列空格中填写A.B.C.D.E、F的结构简式。
A: B: C:
D: E: F:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有丰富的Na+、Mg2+、Cl-、Br-等化学资源。将海水淡化与浓缩海水结合是综合利用海水资源的途径之一。以浓缩海水为原料,通过一系列工艺流程可以提取Mg、Br2等产品。
(1)如图是采用膜分离技术的海水淡化示意图。

淡化膜可以让水分子通过,而海水中其他分子和离子均不能通过。加压后,左侧淡水中增加的是__________(填字母)。
a.溶质质量 b.溶剂质量 c.溶质的质量分数
(2)从海水中提取镁的主要步骤如下:

①操作a的名称是_______________。
②写出B冶炼金属镁的化学方程式_______________________________。
(3)空气吹出法是用于工业规模海水提溴的常用方法,其中一种工艺是以预先经过酸化的浓缩海水为原料,通过以下步骤提取溴:
步骤一:用氯气置换溴离子使之成为单质溴;
步骤二:通入空气和水蒸气,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用转化成氢溴酸;
步骤三:用氯气将氢溴酸氧化得到产品溴。
①步骤一和步骤二的目的是___________________________________。
②步骤二中发生反应的化学方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸镁晶体是一种新型吸波隐形材料中的增强剂。
I.合成该物质的步骤如下:
步骤 1:配制一定浓度的![]() 溶液和
溶液和![]() 溶液。
溶液。
步骤 2:量取一定量的![]() 溶液于容器中,搅拌并逐滴加入
溶液于容器中,搅拌并逐滴加入![]() 溶液,温度控制在 50℃, 用氨水调节溶液 pH 到 9.5。
溶液,温度控制在 50℃, 用氨水调节溶液 pH 到 9.5。
步骤 3:放置1 h后,过滤、洗涤、干燥,得碳酸镁晶体产品[![]() (n=1~5)]。
(n=1~5)]。
回答下列问题:
(1)配制 250 mL 0.5mol/LMgSO4溶液,所需的玻璃仪器除烧杯、玻璃棒和量筒外还有_________。
(2)步骤 2 中反应的离子方程式为_____________________。
(3)检验碳酸镁晶体是否洗干净的方法是_______________________。
Ⅱ.测定产品![]() 中的 n 值(仪器和药品如图所示):
中的 n 值(仪器和药品如图所示):

(4)上述装置的连接顺序为______(按气流方向,用接口字母表示),其中 C 的作用是_________。
(5)加热前先通入![]() 排尽装置中的空气,称取装置 C、D 的初始质量后,边加热边通入
排尽装置中的空气,称取装置 C、D 的初始质量后,边加热边通入![]() 的作用是________。
的作用是________。
(6)若装置 B 中无残留物,要准确测定 n 值,至少需要下列所给数据中的____(填选项字母),写出相应的数学表达式:n=______。
①装置 A 反应前后质量差![]() ②装置 C 反应前后质量差
②装置 C 反应前后质量差![]() ③装置 D 反应前后质量差
③装置 D 反应前后质量差![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选修3:物质的结构与性质】Ⅰ.氟元素是电负性最大的非金属元素,且氟原子的半径小,因此氟单质极易和金属单质反应且把它们氧化到最高价态,如MnF7 、VF5 、CaF2 等。氟元素还可以和氧元素形成氟化物,如OF2 等。
请回答下列问题:

(1)V原子的核外电子排布式为 。如图表示一个不完整的CaF2 晶胞,则图中实心球表示 (填“F-或Ca2+ )。 设晶胞边长为a,则最近的F-和Ca2+之间的距离为 (用含a的代数式表示)。
(2)OF2 分子中氧原子的轨道杂化类型为 ,OF2被称为氟化物而不被称为氧化物的原因是 。
Ⅱ.纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2的化合物。回答下列问题:
(3)写出基态Cu+ 的核外电子排布式 。C、N、O三种元素的第一电离能由大到小的顺序是 。
(4)如图所示是铜的某种氧化物的晶胞示意图,该氧化物的化学式为 。
(5)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,在滴加氨水至沉淀刚全部溶解时可得到蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀。该深蓝色沉淀中的NH3通过键与中心离子Cu2+结合。NH3分子中的N原子杂化方式是 。与NH3分子互为等电子体的一种微粒是 (任写一种)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com