
如图所示,甲、乙均为容积1L的恒容容器,丙为恒压容器。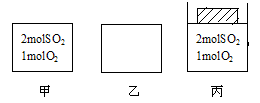
向甲、丙中分别充入相应气体,使丙起始体积为1L,维持500℃发生反应:2SO2+O2  2SO3至平衡。
2SO3至平衡。
甲中反应10min后达到平衡时,容器中SO3的体积分数为91%,则反应从开始至平衡的平均反应速率v(O2)= mol·L-1·min-1,平衡常数表达式为 。SO2的平衡转化率= 。丙中达到平衡所需的时间 10min(填“>”、“=”、“<”),SO3的体积分数 91%(填“>”、“=”、“<”)。若上述已达平衡的甲、丙容器中分别充入0.5molAr气体,容器中SO3的物质的量:甲 丙 (填“增大”、“不变”、“减小”)。
(2)若在乙容器中充入x molSO2 0.2molO2 ymolSO3维持500℃反应至平衡时,容器中SO3的体积分数亦为91%,则x= ,y= 。
(1)0.0938 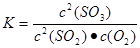 ; 93.8% < > 不变 减小;(2)x=0.4 y=1.6
; 93.8% < > 不变 减小;(2)x=0.4 y=1.6
解析试题分析:(1)根据反应方程式2SO2+O2  2SO3,假如氧气反应消耗xmol.则消耗SO2 2xmol. 产生SO32xmol。由于容器中SO3的体积分数为91%,所以2x÷{(1-x)+(2-2x)+2x}=91%.解得x=0.938.所以v(O2)= 0.938mol÷1L÷10min=0.0938mol/(L·min). 由方程式可知消耗SO2的量与产生的SO3相等。所以平衡时SO2转化率=(2×0.938)÷2×100%=93.8%.当反应达到平衡时的化学平衡常数为
2SO3,假如氧气反应消耗xmol.则消耗SO2 2xmol. 产生SO32xmol。由于容器中SO3的体积分数为91%,所以2x÷{(1-x)+(2-2x)+2x}=91%.解得x=0.938.所以v(O2)= 0.938mol÷1L÷10min=0.0938mol/(L·min). 由方程式可知消耗SO2的量与产生的SO3相等。所以平衡时SO2转化率=(2×0.938)÷2×100%=93.8%.当反应达到平衡时的化学平衡常数为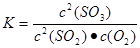 由于甲为恒容的密闭容器。随着反应的进行,体系的压强减小;而丙是恒压的密闭容器。增大压强,物质的浓度增大,化学反应速率加快,达到化学平衡所需要的时间缩短。所以达到平衡所需的时间<10min。增大压强化学平衡向气体体积减小的反应方向移动,即向正反应方向移动,所以SO3的体积分数>91%;若上述已达平衡的甲、丙容器中分别充入0.5molAr气体,甲因为容器的容积不变,所以对平衡无影响,容器中SO3的物质的量不变;而丙容器中由于是恒压,所以容器的容积扩大,各组分气体的气体分压减小,所以平衡逆向移动。因此达到平衡时SO3的物质的量减小。(2)若在乙容器中充入x molSO2 0.2molO2 ymolSO3维持500℃反应至平衡时,容器中SO3的体积分数亦为91%,可以认为ymolSO3不是加入的,而是通过反应消耗SO2 和O2产生的。根据方程式中的物质间的关系可知消耗SO2ymol;消耗O2y/2mol;则开始时加入的SO2为(x+y)mol;加入的O2为(0.2+y/2)mol.由于平衡时容器中SO3的体积分数亦为91%,所以是同一平衡状态。因此(x+y)=2;0.2+y/2=1。解得x=0.4 y=1.6。
由于甲为恒容的密闭容器。随着反应的进行,体系的压强减小;而丙是恒压的密闭容器。增大压强,物质的浓度增大,化学反应速率加快,达到化学平衡所需要的时间缩短。所以达到平衡所需的时间<10min。增大压强化学平衡向气体体积减小的反应方向移动,即向正反应方向移动,所以SO3的体积分数>91%;若上述已达平衡的甲、丙容器中分别充入0.5molAr气体,甲因为容器的容积不变,所以对平衡无影响,容器中SO3的物质的量不变;而丙容器中由于是恒压,所以容器的容积扩大,各组分气体的气体分压减小,所以平衡逆向移动。因此达到平衡时SO3的物质的量减小。(2)若在乙容器中充入x molSO2 0.2molO2 ymolSO3维持500℃反应至平衡时,容器中SO3的体积分数亦为91%,可以认为ymolSO3不是加入的,而是通过反应消耗SO2 和O2产生的。根据方程式中的物质间的关系可知消耗SO2ymol;消耗O2y/2mol;则开始时加入的SO2为(x+y)mol;加入的O2为(0.2+y/2)mol.由于平衡时容器中SO3的体积分数亦为91%,所以是同一平衡状态。因此(x+y)=2;0.2+y/2=1。解得x=0.4 y=1.6。
考点:考查化学平衡常数的表达式、化学反应速率的计算、外界条件对化学反应速率、化学平衡的影响、等效平衡的判断及应用的知识。


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:填空题
据图回答下列问题: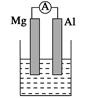
Ⅰ、(1)若烧杯中溶液为稀硫酸,则观察到的现象是______________________
负极反应式为:_________________________________________________。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为________(填Mg或Al),总反应化学方程式为
______________________________________________________________。
Ⅱ、由Al、Cu、浓硝酸组成原电池,其正极的电极反应式为
Ⅲ、(1)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇: CO(g)+2H2(g)  CH3OH(g)。
CH3OH(g)。
分析该反应并回答下列问题:下列各项中,不能够说明该反应已达到平衡的是________(填序号)。
a.恒温、恒容条件下,混合气体的平均相对分子质量不变
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗2 mol H2,同时生成1 mol CH3OH
(2)2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如下图所示。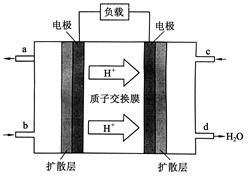
①该电池工作时,b口通入的物质为________________,
c口通入的物质为________________。
②该电池负极的电极反应式为:_______
③工作一段时间后,当6.4 g甲醇完全反应生成CO2时,
有______________NA个电子转移。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)某温度时,在一个2 L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白: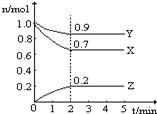
(1)该反应的化学方程式为 ______ __ 。
(2)该反应是由 开始的。(①正反应 ②逆反应 ③正逆反应同时。)
(3)该反应第 ______ 分钟到达平衡状态。
(4)反应开始至3 min,气体X的平均反应速率为 _______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)已知CO2、SO2、NOx是对环境影响较大的气体,请你运用所学知识参与环境治理,使我们周围的空气更好。
(1)硫酸生产中,SO2催化氧化生成SO3,反应混合体系
中SO3的百分含量和温度的关系如右图所示(曲线上
点均为平衡状态)。由图可知: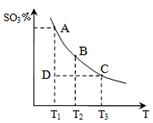
①2SO2(g) + O2(g) 2SO3(g)的△H____0(填“>”或“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不移动”);
2SO3(g)的△H____0(填“>”或“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不移动”);
②若温度为T1时,反应进行到状态D时,v(正)_______v(逆)(填“>”、“<”或“=”);
③硫酸厂的SO2尾气用过量的氨水吸收,对SO2可进行回收及重新利用,反应的化学方程式为 、 ;
④新型氨法烟气脱硫技术是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。其优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为:________(只要求写一种);
(2)汽车尾气(含有烃类、CO、NOx等物质)是城市空气的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。其前半部反应方程式为:
2CO+2NO  2CO2+N2。它的优点是 ;
2CO2+N2。它的优点是 ;
(3)有人设想用图所示装置,运用电化学原理将CO2、SO2转
化为重要化工原料。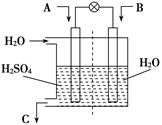
①若A为CO2,B为H2,C为CH3OH,则正极电极反应式为
;
②若A为SO2,B为O2,C为H2SO4。科研人员希望每分钟
从C处获得100 mL 10 mol/L H2SO4,则A处通入烟气(SO2
的体积分数为1%)的速率为 L/min(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O)。
(1)实验室采用如下图所示的装置,可将粗铜与Cl2反应转化为固体1(加热仪器和夹持装置已略去)。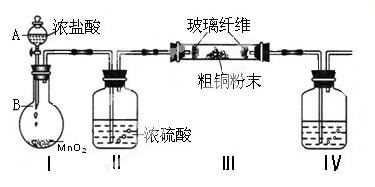
① 仪器A的名称是 。
② 装置B中发生反应的离子方程式是 。
③如果浓盐酸不能顺利滴下,可能的原因是 。
④装置Ⅳ中盛装的试剂是 ,其作用是 。
(2)在CuCl2溶液转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为黄绿色。小组同学欲探究其原因。
已知:在氯化铜溶液中有如下转化关系:
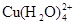 (aq) +4Cl-(aq)
(aq) +4Cl-(aq)
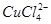 (aq) +4H2O(l)
(aq) +4H2O(l)
蓝色 黄色
①上述反应的化学平衡常数表达式是K= 。
②现欲使溶液由黄色变成蓝色,请写出两种可采用的方法
a. b 。
(3)由CuCl2溶液得到CuCl2·2H2O的过程中要加入盐酸的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
溴及其化合物广泛应用于医药、农药、纤维、塑料组燃剂等,回答下列问题:
(1)海水提溴过程中,向浓缩的海水中通入 ,将其中的Br - 氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为 。
(2)溴与氯能以共价键结合形成BrCl。BrCl分子中, 显正电性。BrCl与水发生反应的化学方程式为 。
(3)CuBr2分解的热化学方程式为:
2CuBr2(s)="2CuBr(s)+" Br2(g) △H=+105.4kJ/mol-1
在密闭容器中将过量CuBr2于487K下加热分解,平衡时p(Br2)为4.66×103Pa。
①如反应体系的体积不变,提高反应温度,则p(Br2)将会 (填“增大”、“不变”或“减小”)。
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O 2NH3+
2NH3+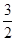 O2
O2
进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
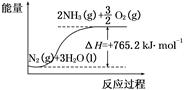
 2NH3(g) ΔH=-92.4 kJ/mol。在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
2NH3(g) ΔH=-92.4 kJ/mol。在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知CO2(g)+3H2(g) CH3OH(l)+H2O(l) ΔH=-130.9 kJ·mol-1
CH3OH(l)+H2O(l) ΔH=-130.9 kJ·mol-1
(1)现将0.8 mol CO2和2.4 mol H2充入容积为20 L的密闭容器中发生上述反应,下列说法正确的是__________(填字母序号)。
| A.该反应在低温下能自发进行 |
| B.当容器内CO2气体体积分数恒定时,该反应已达平衡状态 |
| C.若其他条件不变,实验测得平衡常数:K(T1)>K(T2),则T1<T2 |
| D.现有该反应的X、Y两种催化剂,X能使正反应速率加快约5×105倍、Y能使逆反应速率加快约8×106倍(其他条件相同),故在生产中应该选择X为催化剂更合适 |

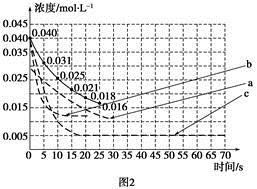
| 实验 编号 | CO2起始 浓度/mol·L-1 | 反应温 度/℃ | 反应压 强/kPa | 是否加入 催化剂 |
| A | 0.030 | 150 | 101 | 否 |
| B | 0.040 | 150 | 101 | 否 |
| C | 0.040 | 250 | 101 | 是 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100 L),在一定条件下发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如图所示。
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如图所示。
①已知100°C时达到平衡所需的时间为5 min,则用H2表示的平均反应速率为________。
②图中的p1________p2(填“<”“>”或“=”),100°C时平衡常数为________。
③在其他条件不变的情况下降低温度,逆反应速率将________(填“增大”“减小”或“不变”)。
(2)在压强为0.1 MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH3OH(g)……Ⅱ。
CH3OH(g)……Ⅱ。
④该反应的ΔH________0,ΔS________0(填“<”“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是________。
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1 mol CO和3 mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下表空格中填入剩余的实验条件数据。
| 实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) |
| ⅰ | 150 | ½ | 0.1 |
| ⅱ | ________ | ________ | 5 |
| ⅲ | 350 | ________ | 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com