
| A. | H2O是一种非常稳定的化合物,这是由于氢键所致 | |
| B. | 原子晶体中,共价键的键长越短,键能越大,熔点就越高 | |
| C. | 分子晶体中,共价键键能越大,该分子的熔沸点就越高 | |
| D. | 分子晶体中,分子间作用力越大,则分子越稳定 |
分析 A.稳定性与氢键无关;
B.影响原子晶体的熔沸点高低的因素为共价键的键能大小;
C.分子晶体的熔点和沸点与分子之间的作用力有关,与分子内的共价键的键能无关;
D.分子间作用力只影响晶体的物理性质,与其稳定性无关.
解答 解:A.H2O是一种非常稳定的化合物,与H-O键有关,而与氢键无关,故A错误;
B.影响原子晶体的熔沸点高低的因素为共价键的键能大小,共价键键长越短、键能越大,晶体的熔点越高,故B正确;
C.分子晶体的熔点和沸点与分子之间的作用力有关,与分子内的共价键的键能无关,故C错误;
D.分子间作用力只影响晶体的物理性质,与其稳定性无关,晶体中分子间作用力越大,其熔沸点越大,故D错误;
故选B.
点评 本题考查不同类型晶体及其化学键、物质的性质,明确晶体的构成粒子、晶体类型即可解答,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于侧链与苯环的相互影响,使侧链和苯环均易被氧化 | |
| B. | 用核磁共振氢谱鉴别1-丙醇、2-丙醇 | |
| C. | 间二溴苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构 | |
| D. | 煤的干馏是现今获得芳香烃的主要途径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
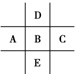 图为周期表的一部分,已知A、B、C、D、E五种元素原子核外共有85个电子,E位于周期表中第四周期,则B元素是( )
图为周期表的一部分,已知A、B、C、D、E五种元素原子核外共有85个电子,E位于周期表中第四周期,则B元素是( )| A. | P | B. | S | C. | Cl | D. | Si |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

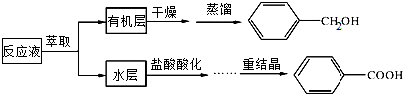
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4和C3H6的混合物的质量为ag,所含碳氢键数目为aNA/7 | |
| B. | 标准状况下,2.24L 2H35Cl中所含中子数为1.8NA | |
| C. | 50mL 12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| D. | 1L 0.1mol•L-1的NaHCO3溶液中$HC{{O}_{3}}^{-}$和$C{{O}_{3}}^{2-}$的离子数之和为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molC5H12O中含有的共价键数目为17NA | |
| B. | 1molNa2O和Na2O2混合物中含有的阴、阳离子总数是3.5NA | |
| C. | 在铁和氯气的反应中,1mol铁失去的电子数为2NA | |
| D. | 1L1mol/L的盐酸溶液中,所含氯化氢分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1 mol•L-1KNO3溶液中滴加稀盐酸使溶液的pH=5,此时混合液中c(K+)<c(NO3-) | |
| B. | 25℃时,0.1 mol•L-1氨水和0.05 mol•L-1氨水中c(OH-)之比是2:1 | |
| C. | 0.1 mol•L-1NH4Cl溶液中c(Cl-)=c(NH4+) | |
| D. | 向CH3COONa溶液中加入适量CH3COOH使混合液pH=7,此时溶液中c(Na+)=c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com