
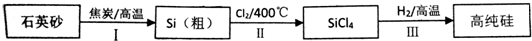
���� ��������̼��ԭ���������Ƶôֹ裺SiO2+2C$\frac{\underline{\;����\;}}{\;}$Si+2CO�����ֹ�������Cl2��Ӧ�Ƶ�SiCl4��Si+2C12$\frac{\underline{\;\;��\;\;}}{\;}$SiCl4���������Ƶô��裺SiCl4+2H2$\frac{\underline{\;����\;}}{\;}$Si+4HCl��
��1��SiO2+2C$\frac{\underline{\;����\;}}{\;}$Si+2CO����CԪ�ػ��ϼ���0�۱�Ϊ+2�ۡ�SiԪ�ػ��ϼ���+4�۱�Ϊ0�ۣ��õ��ӻ��ϼ۽��͵ķ�Ӧ������������ʧ���ӻ��ϼ����ߵķ�Ӧ���ǻ�ԭ����
��2�����̢��е�Cl2�õ�ⱥ��ʳ��ˮ�Ʊ����ö��Ե缫��ⱥ��ʳ��ˮʱ�������������ӷŵ�����������������ˮ�õ����������������������ӣ�
ˮ��������������˽���Ũ�����ˮ����ͬʱ�ܼ��ٷų���������
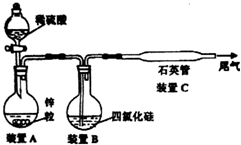
������H2��ԭSiCl4��ʵ������ijЩ����1000-1100��ĸ����½��еģ��ڴ��¶�����ͨ�����ܻ�������
��SiCl4�е�ͣ�57.6����ʹSiCl4��װ��B���ݳ���H2��ֻ�ϣ�Ӧ��ʹ���Ȼ���ת��Ϊ���壻β���к���SiCl4������NaOH��Ӧ���ɹ����ơ�NaCl��ˮ��
��SiCl4�ڳ�ʪ�Ŀ������ܷ���ˮ�ⷴӦ��Ϊ��ֹ���Ȼ���ˮ�⣬��Ҫʹ�ø�������������Ȼ���ˮ������HCl������������Һ���в�����ɫ��״���ʣ�
��Fe��ϡ���ᷴӦ�����������ӣ����������ܺ�NaOH��Ӧ���ɰ�ɫ�������Ҹð�ɫ�������ȶ����ױ��������ɺ��ɫ������
��� �⣺��������̼��ԭ���������Ƶôֹ裺SiO2+2C$\frac{\underline{\;����\;}}{\;}$Si+2CO�����ֹ�������Cl2��Ӧ�Ƶ�SiCl4��Si+2C12$\frac{\underline{\;\;��\;\;}}{\;}$SiCl4���������Ƶô��裺SiCl4+2H2$\frac{\underline{\;����\;}}{\;}$Si+4HCl��
��1��SiO2+2C$\frac{\underline{\;����\;}}{\;}$Si+2CO����CԪ�ػ��ϼ���0�۱�Ϊ+2�ۡ�SiԪ�ػ��ϼ���+4�۱�Ϊ0�ۣ��õ��ӻ��ϼ۽��͵ķ�Ӧ������������ʧ���ӻ��ϼ����ߵķ�Ӧ���ǻ�ԭ����������������������C�ǻ�ԭ�������������ͻ�ԭ�������ʵ���֮��Ϊ1��2���ʴ�Ϊ��1��2��
��2�����̢��е�Cl2�õ�ⱥ��ʳ��ˮ�Ʊ����ö��Ե缫��ⱥ��ʳ��ˮʱ�������������ӷŵ�����������������ˮ�õ����������������������ӣ���Ӧ����ʽΪ2NaCl+2H2O$\frac{\underline{\;���\;}}{\;}$2NaOH+Cl2��+H2����
ˮ��������������˽���Ũ�����ˮ�����Ӷ�����Ũ�����������ˮ�ԣ�ͬʱ�ܼ��ٷų���������
�ʴ�Ϊ��2NaCl+2H2O$\frac{\underline{\;���\;}}{\;}$2NaOH+Cl2��+H2����ʹˮ�������������ٽ���Ũ�����ˮ�������ֳ�������ˮ�ԣ�ͬʱ�����˷ų���������
������H2��ԭSiCl4��ʵ������ijЩ����1000-1100��ĸ����½��еģ��ڴ��¶�����ͨ�����ܻ�������ʯӢ�������£�������ʯӢ�ܶ�������ͨ�����ܣ��ʴ�Ϊ������ʱ��ͨ�����ܻ�������ʯӢ�����£�
��SiCl4�е�ͣ�57.6����ʹSiCl4��װ��B���ݳ���H2��ֻ�ϣ�Ӧ��ʹ���Ȼ���ת��Ϊ���壬���Զ�Bװ�ý���ˮԡ���ȣ�β���к���SiCl4������NaOH��Ӧ���ɹ����ơ�NaCl��ˮ����Ӧ����ʽΪSiCl4+6NaOH=Na2SiO3+4NaCl+3H2O��
�ʴ�Ϊ����Bװ�ý���ˮԡ���ȣ�SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O��
��SiCl4�ڳ�ʪ�Ŀ������ܷ���ˮ�ⷴӦ��Ϊ��ֹ���Ȼ���ˮ�⣬��Ҫʹ�ø����������������Ҫ��A��B֮������һʢ��Ũ�����ϴ��ƿ��ʢ�м�ʯ�ҵĸ���ܣ����Ȼ���ˮ������HCl������������ͬʱ���������ԵĹ��������Һ���в�����ɫ��״���ʣ�
�ʴ�Ϊ����A��B֮������һʢ��Ũ�����ϴ��ƿ��ʢ�м�ʯ�ҵĸ���ܣ�B��Һ���Ϸ���������������Һ������������ɫ��״�����ɣ�
��Fe��ϡ���ᷴӦ�����������ӣ����������ܺ�NaOH��Ӧ���ɰ�ɫ�������Ҹð�ɫ�������ȶ����ױ��������ɺ��ɫ��������ˮ���������ƺ�KSCN�������������ӷ�Ӧ��û������ѡ���ѡc��
���� ������Si���仯����Ϊ���忼�������Ʊ���Ϊ��Ƶ���㣬���ؿ���ѧ����������ȡ��Ϣ������Ϣ���������������ȷ����ͼ�з����ķ�Ӧ�����������ǽⱾ��ؼ���ע������йؼ��ʡ�SiCl4�۵�Ϊ-70�棬�е�57.6�棬�ڳ�ʪ�Ŀ������ܷ���ˮ�ⷴӦ����������ùؼ��ʽ�����⣬��Ŀ�ѶȲ���


 ��ѧ��������������Ͼ���ѧ������ϵ�д�
��ѧ��������������Ͼ���ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Է������� M=$\frac{22.4mw}{[��1-w��V]}$ | B�� | ���ʵ���Ũ�� c=$\frac{1000dV}{��MV+22.4m��}$ | ||
| C�� | ���ʵ��������� w=$\frac{MV}{22.4m}$ | D�� | ��Һ�ܶ� d=$\frac{cM}{1000w}$ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | ��Է������� | ��״ | �۵� | �е� | �ܶ� | �ܽ�� | ||
| ˮ | �Ҵ� | ���� | ||||||
| �ױ� | 92 | ��ɫҺ����ȼ�ӷ� | -95 | 110.6 | 0.8669 | ���� | �� | �� |
| ������ | 122 | ��ɫƬ״����״���� | 122.4 | 248 | 1.2659 | �� | ���� | ���� |
 ������������
��������Ϊ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
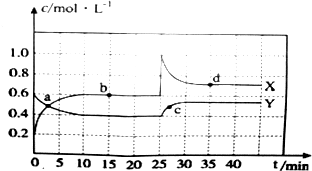
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������ˮ��Ӧ��Na+H2O�TNa++H2 | |
| B�� | �Ȼ����Һ�����Ե�ԭ��NH4++H2O�TNH3•H2O+H+ | |
| C�� | AICl3��Һ�м���������ˮ��Al3++4NH3•H2O�TAlO2-+4NH4+2H2O | |
| D�� | �Ȼ�����Һ�еμ�������������Һ��2Fe3++H2S�T2Fe2++S+2H+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
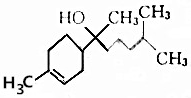
| A�� | ����ʽΪC15H26O | B�� | �ܺ�NaHCO3��Һ��Ӧ����CO2 | ||
| C�� | ����ʹ���Ը��������Һ��ɫ | D�� | �������ᷢ��ȡ����Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������


�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com