
分析 晶格能是指:在反应时1mol离子化合物中的阴、阳离子从相互分离的气体离子结合成离子晶体时所放出的能量,
已知:①Rb(s)═Rb(g)△H1=+78kJ•mol-1
②Rb(g)-e-═Rb+(g)△H2=+402kJ•mol-1
③F2(g)═2F(g)△H3=+160kJ•mol-1
④F(g)+e-═F-(g)△H4=-350kJ•mol-1
⑤2Rb(s)+F2(g)═2RbF(s)△H5=-1104kJ•mol-1.
根据盖斯定律,⑤×$\frac{1}{2}$-③×$\frac{1}{2}$-④-②-①可得:F-(g)+Rb+(g)═RbF(s).
解答 解:晶格能是指:在反应时1mol离子化合物中的阴、阳离子从相互分离的气体离子结合成离子晶体时所放出的能量,
已知:①Rb(s)═Rb(g)△H1=+78kJ•mol-1
②Rb(g)-e-═Rb+(g)△H2=+402kJ•mol-1
③F2(g)═2F(g)△H3=+160kJ•mol-1
④F(g)+e-═F-(g)△H4=-350kJ•mol-1
⑤2Rb(s)+F2(g)═2RbF(s)△H5=-1104kJ•mol-1.
根据盖斯定律,⑤×$\frac{1}{2}$-③×$\frac{1}{2}$-④-②-①可得:F-(g)+Rb+(g)═RbF(s),所以△H=$\frac{1}{2}$×(-1104kJ•mol-1)-$\frac{1}{2}$×160kJ•mol-1-(-350kJ•mol-1)-402kJ•mol-1-78kJ•mol-1=-762kJ•mol-1,
故RbF的晶格能的晶格能为762kJ/mol,
答:RbF的晶格能的晶格能为762kJ/mol.
点评 本题考查运用盖斯定律计算反应热,中学基本不涉及晶格能问题,关键是晶格能概念的理解,为易错题目.


科目:高中化学 来源: 题型:解答题
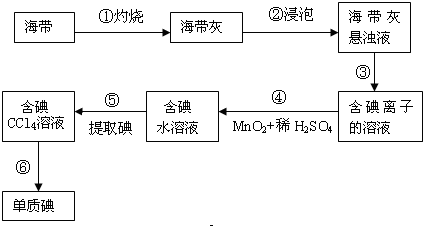
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
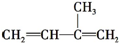 )是一种重要的二烯烃,它是天然橡胶的单体.
)是一种重要的二烯烃,它是天然橡胶的单体.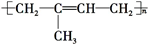 .
.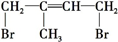 、
、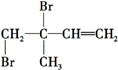 、
、
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
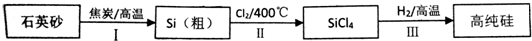
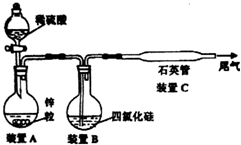
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| B. | 铝制品由于表面有致密的氧化膜,可以稳定存在于空气中 | |
| C. | 苹果放在空气中久置变黄和漂白过纸张久置变黄原理相似 | |
| D. | 高纯度的SiO2对光有很好的折射和全反射作用,可以制成光电池将光能直接转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
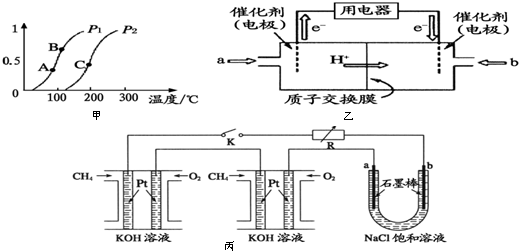
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝钠合金的熔点比铝低 | |
| B. | 铝钠合金若投入一定的水中可得无色溶液,则n(Al)≤n(Na) | |
| C. | 铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出 | |
| D. | m g不同组成的铝钠合金投入足量盐酸中,放出的H 2 越多,则铝的质量分数越小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com