
 Fe(s)+ CO2(g) ��H>0
Fe(s)+ CO2(g) ��H>0 ���Ӣ��������ϵ�д�
���Ӣ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
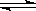 2C��g������2 s ����C��Ũ��Ϊ0.6 mol/L������˵������ȷ���ǣ���������
2C��g������2 s ����C��Ũ��Ϊ0.6 mol/L������˵������ȷ���ǣ����������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
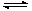 2B(g)+C(g) ����H>0��Ҫʹ�淴Ӧ��������A��Ũ�ȼ�С��ֻ�ı�һ����������Ӧ��ȡ�Ĵ�ʩ�ǣ� ��
2B(g)+C(g) ����H>0��Ҫʹ�淴Ӧ��������A��Ũ�ȼ�С��ֻ�ı�һ����������Ӧ��ȡ�Ĵ�ʩ�ǣ� ��| A����ѹ | B������ | C��������ʵĴ��� | D������B��Ũ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g)(����ӦΪ���ȷ�Ӧ)����������C�����������ʱ��Ĺ�ϵ��ͼ��ʾ����a��b���߲�ͬ�Ŀ���ԭ����
2C(g)(����ӦΪ���ȷ�Ӧ)����������C�����������ʱ��Ĺ�ϵ��ͼ��ʾ����a��b���߲�ͬ�Ŀ���ԭ���� 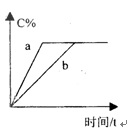
| A��a���¶ȸ���b |
| B��aʹ���˴�������bδ�� |
| C��a��ѹǿ����b |
| D��a���¶ȵ���b |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����¡���ѹʱ������NH3 | B�����¡�����ʱ������N2 |
| C�����¡���ѹʱ������He | D�����¡�����ʱ������He |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
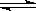 3Y(g)+Z(g)�ﵽƽ��ʱ����30%��X�����ֽ⣬��ƽ��ʱ��������ܵ����ʵ�����
3Y(g)+Z(g)�ﵽƽ��ʱ����30%��X�����ֽ⣬��ƽ��ʱ��������ܵ����ʵ�����| A��4mol | B��3.4mol | C��2.8mol | D��1.2mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2H2��O2��2CO��O2
2H2��O2��2CO��O2 2CO2
2CO2�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
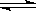 2NH3���ﵽƽ�����H2��ת���ʿ�����
2NH3���ﵽƽ�����H2��ת���ʿ�����| A��35% | B��30% | C��25% | D��75% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
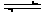 2NO��O2������һ��ʱ���û������NO2Ũ��Ϊ0.06 mol������1�� O2��Ũ��Ϊ0.12 mol������1���Ҹ����ʵ�Ũ�Ȳ��ٷ����仯��
2NO��O2������һ��ʱ���û������NO2Ũ��Ϊ0.06 mol������1�� O2��Ũ��Ϊ0.12 mol������1���Ҹ����ʵ�Ũ�Ȳ��ٷ����仯���鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com