
【题目】研究人员发现了一种“水”电池,其总反应为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。如图用“水”电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出。下列有关分析正确的是( )

A. I为负极,其电极反应式为Ag+Cl-+e-=AgCl
B. “水”电池内Na+不断向负极作定向移动
C. 每转移1mole-,U型管中消耗0.5molH2O
D. “水”电池内,每生成1molNa2Mn5O10,X电极上生成1mol气体
【答案】D
【解析】试题分析:A.X电极上有无色气体逸出,应为阴极,生成氢气,则Ⅰ为负极,根据电池总反应可判断出反应中Ag的化合价升高,被氧化,Ag应为原电池的负极,AgCl是氧化产物,则负极发生Ag+Cl--e-=AgCl,故A错误;B.原电池工作时,阳离子向正极移动,所以“水”电池内Na+不断向正极作定向移动,故B错误;C.每转移1mole-,由2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑,可知生成0.5mol氢气,消耗1mol水,故C错误;D.方程式中5MnO2生成1Na2Mn5O10,化合价共降低了2价,所以每生成1molNa2Mn5O10转移2mol电子,又X电极上有无色气体逸出,即电极反应为2H2O+2e-=2OH-+H2↑,所以X电极上生成1 mol气体,故D正确。故选D。
2OH-+H2↑+Cl2↑,可知生成0.5mol氢气,消耗1mol水,故C错误;D.方程式中5MnO2生成1Na2Mn5O10,化合价共降低了2价,所以每生成1molNa2Mn5O10转移2mol电子,又X电极上有无色气体逸出,即电极反应为2H2O+2e-=2OH-+H2↑,所以X电极上生成1 mol气体,故D正确。故选D。


科目:高中化学 来源: 题型:
【题目】已知:(1)Zn(s)+1/2O2(g)==ZnO(s),ΔH=-348.3kJ/mol
(2)2Ag(s)+1/2 O2(g)=Ag2O(s),ΔH=-31.0kJ/mol
则Zn(s)+ Ag2O(s)=ZnO(s)+ 2Ag(s)的ΔH等于( )
A.-317.3kJ/mol B.-379.3kJ/mol C.-332.8 kJ/mol D.317.3 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3→K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol,则下列判断正确的是( )
A.生成42.0 L N2(标准状况)
B.有0.250 mol KNO3被氧化
C.转移电子的物质的量为2.25 mol
D.被氧化的N原子的物质的量为3.75 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如下图所示,试回答:
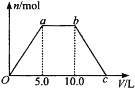
(1)a点之前的反应的离子方程式为________________。
(2)a点到b点之间的反应的离子方程式是________________、________________。
(3)c点二氧化碳体积是________L。
(4)混合稀溶液中Ba(OH)2和NaOH的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列各组中的实验步骤和现象,分析正确的一项是
选项 | 实验现象 | 原因分析 |
A | 证明酸性条件下H2 O2氧化性比I2强10.关于下列各装置的叙述正确的是( )A.装置①可用于实验室制备NO气体B.装置②可肜于模拟海水蒸馏 C.装置③可用于探究碳酸氢钠的热稳定性 D.装置④为配制溶液过程中的定容操作 11.下列说法正确的是( ) A.将铁粉加入FeCl3、Cucl2混合溶液中,充分反应后剩余的固体中必有铁 B.CO2和SO2混合气体分别通入BaCl2溶液、Ba(NO3)2溶液中,最终都有沉淀生成 C.钠、镁着火时,不可用泡沫灭火器灭火 D.用加热分解的方法可将NH4Cl固体和Ca(OH)2固体的混合物分离 12.对下列各组中的实验 | 碘化钠溶液 |
B | 新制氯水中滴加石蕊试液,溶液先变红,后褪色 | 氯气与水反应生成HCl、HClO,HCl、HClO显酸性,使石蕊变红,Cl2具有强氧化性,使褪色 |
C | SO2通入溴水中,溴水褪色 | SO2具有漂白性,使其褪色 |
D | 向湿润蔗糖中加入浓硫酸,固体迅速变黑,后体积急剧膨胀 | 在浓硫酸脱水作用下,蔗糖被炭化,炭与浓硫酸反应生成CO2、SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是 ;
(2)X与金属钠反应放出氢气,反应的化学方程式是 ;
(3)X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是 ;
(4)X与高锰酸钾酸性溶液反应可生成Z,Z的结构简式是 。在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W,若184gX和120gZ反应能生成106gW,计算该反应W的产率。(产率是指某种生成物的实际产量与理论产量的比值。要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015新课标2】某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol羧酸和2mol乙醇,该羧酸的分子式为( )
A.C14H18O5 B.C14H16O4 C.C14H22O5 D.C14H10O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁([CH3CH(OH)COO]2Fe.3H2O,Mr=288)是一种常用的补铁剂,可通过是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe·3H2O+CO2↑。
已知FeCO3易被氧化:4FeCO3+6H2O+O2=4Fe(OH)3+4CO2。
某兴趣小组用FeCl2(用铁粉和稀盐酸制得)和NH4HCO3制备FeCO3的装置示意图如下:
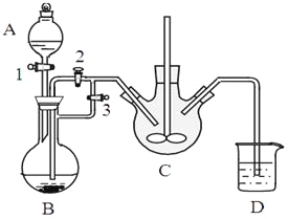
回答下列问题:
(1)NH4HCO3盛放在装置 中(填字母),该装置中涉及的主要反应的离子方程式____________。
(2)将生成的FeCl2溶液和NH4HCO3溶液混合时的操作是_________________。
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75℃下搅拌反应。铁粉的作用是________,
反应结束后,无需过滤,除去过量铁粉的方法是 。
(4)该兴趣小组用KMnO4法测定样品中亚铁含量进而计算产品中乳酸亚铁的质量分数,高锰酸钾标准液用_________滴定管盛装(填“酸式”或“碱式”)。下列操作会引起测定结果偏高的是_________。
A.滴定管在盛装高锰酸钾前未润洗
B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C.滴定前读数正确,滴定终点时俯视读数
D.滴定前读数正确,滴定终点时仰视读数
(5)经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量。取2.880g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.1000mol·L-1Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)2 19.70mL。滴定反应如下:Ce4++Fe2+=Ce3++Fe3+,则产品中乳酸亚铁的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com