

| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol•L-1) | c1 | 3 | |
| N2的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度(g•L-1) | ρ1 | ρ2 |
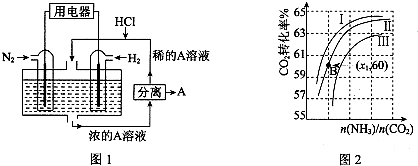
分析 Ⅰ.分别根据图1、图2、图3写出热化学方程式,然后根据盖斯定律来解答;
Ⅱ.(1)达到平衡状态时,正逆反应速率相等,各物质的浓度不变,以此判断.
(2)甲容器比乙容器中反应物的浓度小,反应速率比乙中小,故达到平衡所需要的时间更长;
(3)先计算出用氮气表示的反应速率,然后利用化学计量数关系计算出用氢气表示的反应速率;
(4)先将丙中的数据按照化学计量数转化成反应物氮气、氢气的物质的量,然后利用等效平衡知识进行分析;
(5)计算出反应前氮气、氢气的物质的量浓度,然后利用化学平衡三段式计算出达到平衡时各组分的浓度,最后根据化学平衡常数表达式计算出该温度下的平衡常数;
(6)根据平衡常数和水的离子积常数综合求解,比较两种离子对应的弱电解质的电离度的大小确定溶液的酸碱性;
Ⅲ.(1)电池正极发生还原反应,A是生成的氯化铵;
(2)①依据反应转化率的大小分析,结合图象分析判断;
②根据氨气和二氧化碳的转化率之比求出x1.
解答 解:Ⅰ.图1、图2、图3写出热化学方程式分别为:
①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-akJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-bkJ•mol-1
③CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-ckJ•mol-1,
由③-(①+②×3)得:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=(a+3b-c)kJ•mol-1,
故答案为:a+3b-c;
Ⅱ.(1)a.容器内N2、H2、NH3的浓度之比为1:3:2,不能说明达到判断状态,取决于起始配料比和转化程度,故a错误;
b.当3v(N2)正=v(H2)逆时,才说明达到平衡状态,故b错误;
c.容器内压强保持不变,可说明达到平衡状态,故c正确;
d.恒容时体积不变,质量不变,则混合气体的密度保持不变,不能达到平衡状态,故d错误.
故答案为:c;
(2)若为恒压容器,甲乙容器中达到平衡所用时间相同,为5min,但是容器恒容,甲容器比乙容器中反应物的浓度小,反应速率比乙中小,故达到平衡所需要的时间更长,即t>5min,故答案为:>;
(3)容器乙中,反应前氮气的浓度为:$\frac{4mol}{1L}$=4mol/L,氮气的平均反应速率为:v(N2)=$\frac{4mol/L-3mol/L}{5min}$=0.2mol•L-1•min-1,
故答案为:0.2 mol•L-1•min-1;
(4)恒温、恒容条件下:
a.假设乙容器的容积为2L,则达到平衡时甲乙为等效平衡,各组分的含量、浓度相等,此时氮气的浓度为c1,然后将容器的容积缩小到2L,若平衡不移动,2c1=3mol/L,由于压强增大,平衡向着正向移动,所以2c1>3mol/L,故a错误;
b.乙中加入了4mol氮气、6mol氢气,而甲中为3mol H2、2mol N2,故乙对甲来说相当于加压,平衡右移,氮气的体积分数减小,所以ω2<ω1,故b错误;
c.反应前后都是气体,容器的容积都是2L,乙中混合气体的质量为甲的2倍,根据ρ=$\frac{m}{V}$可知:2ρ1=ρ2,故c正确;
故选c,
故答案为:c;
(5)乙容器中,反应前氢气浓度为:c(H2)=$\frac{6mol}{1L}$=4mol/L,氮气的浓度为:$\frac{4mol}{1L}$=4mol/L,达到平衡时氮气的浓度变化为:(4-3)=1mol/L,
由三段式可知:3H2 (g)+N2(g)?2NH3(g)
反应前(mol/L):6 4 0
浓度变化(mol/L):3 1 2
反应后:(mol/L):3 3 2
在该温度下乙容器中反应的平衡常数K=$\frac{{2}^{2}}{{3}^{3}×3}$=$\frac{4}{81}$,
故答案为:$\frac{4}{81}$;
(6)NH4+(aq)+H2O(l)?NH3•H2O(aq)+H+(aq)平衡常数的表达式为:K=$\frac{c({H}^{+})×c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$=$\frac{c({H}^{+})×c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$×$\frac{c(O{H}^{-})}{c(O{H}^{-})}$=$\frac{Kw}{Kb}$=5.55×10-10mol•L-1,所以Kb=1.80×10-5mol•L-1,因为Ka1=5.9×10-2>Kb,所以草酸氢铵的水溶液中,呈酸性,所以离子浓度的大小顺序为:c(NH4+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),
故答案为:1.80×10-5mol•L-1;c(NH4+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
Ⅲ.(1)电池正极发生还原反应,氮气得电子发生还原反应,N2+8H++6e-=2NH4+,A是铵根离子与氯离子结合形成氯化铵,
故答案为:N2+8H++6e-=2NH4+;氯化铵;
(2)①氨碳比相同时曲线Ⅰ二氧化碳的转化率大,所以生产中选用水碳比的数值为Ⅲ,故答案为:Ⅲ;
②由题意可知:2NH3(g)+CO2(g)?CO(NH2)2+H2O(g)
起始量 x1 1
变化量 2a a
$\frac{{x}_{1}}{2a}$=$\frac{1}{a}$=40%,
则x1=3,
故答案为:3.
点评 本题考查较为综合,涉及化学反应与能量、化学平衡的影响因素、化学平衡、速率的计算等,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,注意利用三段式法计算,较为直观,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 放电时,负极反应为:Zn+4OH--2e-=Zn(OH)42- | |
| B. | 充电时,电解质溶液中K+向阳极移动 | |
| C. | 充电时,电解质溶液中c(OH-)逐渐减小 | |
| D. | 放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以Na2O2作供氧剂时,发生了氧化还原反应 | |
| B. | 在食品袋中放人CaCl2•6H2O,可防止食物受潮 | |
| C. | 人工合成食品级酯可以用作糖果的香料 | |
| D. | 用NH4Cl浓溶液除铁锈,因为NH4 Cl水解显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只生成AgBr及AgI两种沉淀 | B. | 溶液中c(I-)≈1.0×10-9mol/L | ||
| C. | 溶液中c(Br-)≈3.0×10-5mol/L | D. | 溶液中c(Ag+)≈3.2×10-8mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 氮氧化物是大气污染物之一,目前,消除氮氧化物的方法有多种.
氮氧化物是大气污染物之一,目前,消除氮氧化物的方法有多种.| 化学键 | O═O | C═O | C≡O |
| 键能(Kj/moL) | 497 | 803 | 1072 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操 作 | 现 象 | 解释、结论 |
| A | 把过量的Fe粉中加入硝酸中充分反应,滴入KSCN溶液 | 溶液呈红色 | 稀硝酸将Fe氧化为Fe3+ |
| B | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | 析出了Na2CO3晶体 |
| C | 定容时不小心加水超过容量瓶的刻度线,立即用滴管吸去多余的部分 | 液体凹液面与刻度线相平 | 配制溶液的浓度不受影响 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ④②①②③ | C. | ④①② | D. | ①③②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com