
| ѡ�� | �� �� | �� �� | ���͡����� |
| A | �ѹ�����Fe���м��������г�ַ�Ӧ������KSCN��Һ | ��Һ�ʺ�ɫ | ϡ���ὫFe����ΪFe3+ |
| B | ��Na2CO3��Һ��ͨ������CO2 | ��Һ����� | ������Na2CO3���� |
| C | ����ʱ��С�ļ�ˮ��������ƿ�Ŀ̶��ߣ������õι���ȥ����IJ��� | Һ�尼Һ����̶�����ƽ | ������Һ��Ũ�Ȳ���Ӱ�� |
| D | �ò�����պȡŨ��ˮ�㵽��ɫʯ����ֽ�� | ��ֽ����ɫ | Ũ��ˮ�ʼ��� |
| A�� | A | B�� | B | C�� | C | D�� | D |
���� A��������Fe����ϡHNO3��Ӧ����Fe2+��
B��̼�����Ƶ��ܽ�ȱ�̼���Ƶ��ܽ��С��
C����ˮ��������ƿ�Ŀ̶��ߣ��˴�����ʧ�ܣ���Ҫ�������ƣ�
D����ʹ��ɫʯ����ֽ����ɫ����Һ�ʼ��ԣ�
��� �⣺A��������Fe����ϡHNO3��Ӧ����Fe2+�����Թ�����Fe���м���ϡHNO3����ַ�Ӧ�����KSCN��Һ����Һ�����ɫ����A����
B��̼�����Ƶ��ܽ�ȱ�̼���Ƶ��ܽ��С����Na2CO3������Һ��ͨ������CO2��Na2CO3��CO2��Ӧ����NaHCO3�����Ի�����NaHCO3����B����
C������ʱ��С�ļ�ˮ��������ƿ�Ŀ̶��ߣ����Ƶ���Һ���ƫ����ҺŨ��ƫ�ͣ�Ӧ���������ƣ���C����
D����ʹ��ɫʯ����ֽ����ɫ����Һ�ʼ��ԣ��ò�����պȡŨ��ˮ�㵽��ɫʯ����ֽ�ϣ���ֽ����ɫ˵��Ũ��ˮ�ʼ��ԣ���D��ȷ��
��ѡD��
���� ���⿼���Ϊ�ۺϣ��漰̼���ƺ�̼�����Ƶ����ʡ����Ӽ��顢��Һ���Ƶ�֪ʶ����Ŀ�ѶȲ������������ѧ���ķ���������ʵ�����������������Ŀ��飬ע��������ʵ�鷽����ע�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������


| �¶�/�� | 1000 | 1115 | 1300 |
| ƽ�ⳣ�� | 4.0 | 3.7 | 3.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| �� �� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 3mol H2��2mol N2 | 6mol H2��4mol N2 | 2mol NH3 |
| �ﵽƽ���ʱ�䣨min�� | t | 5 | 8 |
| ƽ��ʱN2��Ũ�ȣ�mol•L-1�� | c1 | 3 | |
| N2��������� | ��1 | ��2 | ��3 |
| ��������ܶȣ�g•L-1�� | ��1 | ��2 |
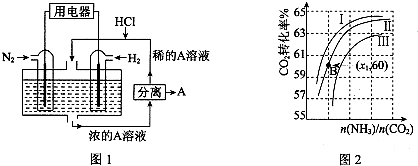
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��ͼ���о������������ʵ���ʵ��װ�ã�����60%������Һ���������ƾ��巴Ӧ��ȡSO2���壬ʵ����������ԣ��Ҳ�����Ⱦ����������˵���д�����ǣ�������
��ͼ���о������������ʵ���ʵ��װ�ã�����60%������Һ���������ƾ��巴Ӧ��ȡSO2���壬ʵ����������ԣ��Ҳ�����Ⱦ����������˵���д�����ǣ�������| A�� | ��ɫʯ����Һ���ɫ��˵��SO2������ | |
| B�� | Ʒ����Һ��ɫ��˵��SO2����Ư���� | |
| C�� | ��ˮ��ɫ��ȥ��������SO2�Ļ�ԭ�� | |
| D�� | ����̪��NaOH��Һ��ɫ��dz������SO2�ܹ���NaOH��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
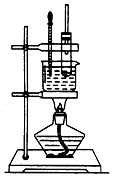 ʵ�����Ʊ���������ʵ��װ����ͼ��ʾ����д���пհף�
ʵ�����Ʊ���������ʵ��װ����ͼ��ʾ����д���пհף��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ֽ� | B�� | ������������Ӧ | C�� | ������������Ӧ | D�� | ������������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HBr | B�� | CH3COOH | C�� | BaSO4 | D�� | CH3COONa |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com