
| 2.24L |
| 22.4L/mol |
| 64x+71y |
| x+y |
| 2.24L |
| 22.4L/mol |
| 64x+71y |
| x+y |
| m |
| ρ |
| 64g/mol×0.05mol+71g/mol×0.05mol+100g |
| 1.05g/cm3 |
| 0.2mol |
| 0.1017L |


科目:高中化学 来源: 题型:
| A、甲烷的分子式为CH4 |
| B、甲烷中含有碳元素和氢元素 |
| C、甲烷中只含碳元素和氢元素 |
| D、甲烷的化学性质比较稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
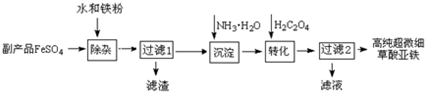
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用等体积的蒸馏水或0.01mol/L盐酸洗涤AgCl沉淀,AgCl的损失量相同 |
| B、向氨水中加入NH4Cl 或Na2CO3 固体,溶液的pH均增大,水的电离程度均增大 |
| C、稀醋酸加入少量NaOH,恢复至室温后溶液的H+浓度减少,醋酸电离平衡常数不变 |
| D、NaClO与Na2CO3等物质的量混合的溶液中:c(Na+ )+c(H+)=c(OH-)+c(ClO-)+c(HCO3 -)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、洗净的锥形瓶和容量瓶可以放进烘箱中烘干 |
| B、用激光笔检验KI溶液中是否溶有淀粉 |
| C、配制硫酸亚铁溶液时,应将绿矾晶体溶于蒸馏水再加入一定量的铁粉 |
| D、用分液漏斗分离乙酸乙酯和饱和碳酸钠溶液时,应打开活塞,使乙酸乙酯缓慢流出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
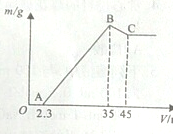 准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol?L-1的NaOH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示.请回答下列问题:
准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol?L-1的NaOH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com