
【题目】化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是( )

A.甲:可用Zn电极代替Cu电极作正极
B.乙:通入氧气的一极为正极
C.丙:锌筒作负极,发生氧化反应,锌筒会变薄
D.丁:原电池Pb+PbO2+2H2SO4=2PbSO4+2H2O中,PbO2发生还原反应作正极
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】实验室制取氨气、收集、验证其还原性并进行尾气处理的装置和原理能达到实验目的的是
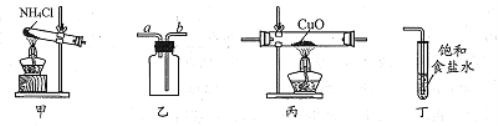
A.用装置甲制取氨气
B.用装置乙收集氨气时气体应该从a口进b口出
C.装置丙中黑色固体变成红色时还原产物一定为铜
D.可以用装置丁吸收氨气,进行尾气处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1molL-1HCl溶液滴定10.0mL浓度为0.1molL-1Na2CO3溶液,所得滴定曲线如图所示。下列微粒浓度大小关系正确的是
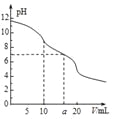
A. 当V=0时:c(H+)+c(HCO3-)+c(H2CO3)=c(OH-)
B. 当V=5时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-)
C. 当V=10时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
D. 当V=a时:c(Na+)=c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计了如下实验测定海带中碘元素的含量,依次经过以下四个步骤,下列图示装置和原理能达到实验目的的是
A.灼烧海带
B.将海带灰溶解后分离出不溶性杂质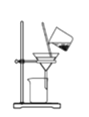
C.制备Cl2,并将I-氧化为I2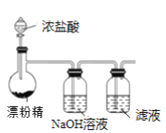
D.以淀粉为指示剂,用Na2SO3标准溶液滴定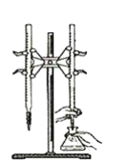
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及其化合物的说法正确的是( )
A.陶瓷、玻璃、水泥容器都能贮存氢氟酸
B.硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在具有磨口玻璃塞的试剂瓶中
C.用![]() 制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通过
制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通过![]()
D.由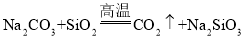 可知,硅酸的酸性强于碳酸
可知,硅酸的酸性强于碳酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,则这个碳原子被称为“手性碳原子”,凡含有手性碳原子的物质一定具有光学活性,如物质 有光学活性,发生下列反应后生成的有机物无光学活性的是( )
有光学活性,发生下列反应后生成的有机物无光学活性的是( )
①与甲酸发生酯化反应 ②与NaOH溶液反应 ③与银氨溶液作用 ④在催化剂存在下与氢气作用
A. ①③B. ②④
C. ①④D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家从化肥厂生产的![]() 中检出组成为
中检出组成为![]() 的物质,经测定,该物质易溶于水,在水中以
的物质,经测定,该物质易溶于水,在水中以![]() 和
和![]() 两种离子形式存在,植物的根系易吸收
两种离子形式存在,植物的根系易吸收![]() ,但它遇到碱时,会生成一种形似白磷的
,但它遇到碱时,会生成一种形似白磷的![]() 分子,
分子,![]() 分子不能被植物吸收。
分子不能被植物吸收。
请回答下列问题:
![]() 和
和![]() 的关系正确的是 ______
的关系正确的是 ______ ![]() 填序号
填序号![]() 。
。
A.同种单质![]() 同位素
同位素![]() 同分异构体
同分异构体![]() 同素异形体
同素异形体
![]() ______
______ ![]() 填“能”或“不能”
填“能”或“不能”![]() 和草木灰混合施用。
和草木灰混合施用。
![]() 已知断裂
已知断裂![]() 吸收167kJ热量,生成1molN
吸收167kJ热量,生成1molN![]() N放出
N放出![]() 的热量,写出
的热量,写出![]() 气体转变为
气体转变为![]() 的热化学方程式: ______ 。
的热化学方程式: ______ 。
![]() 已知白磷、
已知白磷、![]() 、
、![]() 的空间构型均为四面体,
的空间构型均为四面体,![]() 的结构式为
的结构式为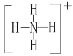 ,白磷
,白磷![]() 的结构式为
的结构式为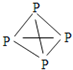 ,请画出
,请画出![]() 的结构式 ______ 。
的结构式 ______ 。
![]() 已知液氨中存在着平衡
已知液氨中存在着平衡![]() ,科学家在液氨中加入氢氧化铯
,科学家在液氨中加入氢氧化铯![]() 和特殊的吸水剂,使液氨中的
和特殊的吸水剂,使液氨中的![]() 生成
生成![]() 分子和另一种单质气体,请写出液氨与氢氧化铯反应的化学方程式: ______ 。
分子和另一种单质气体,请写出液氨与氢氧化铯反应的化学方程式: ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①0.1 mol/L (NH4)2SO4溶液中各种离子的浓度由大到小顺序为__________。
②用离子方程式表示NaHCO3溶液显碱性的原因:______________。实验室中配制FeCl3溶液时常加入________溶液以抑制其水解。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=____________mol/L,在pH=3的CH3COOH溶液中,水电离出的c(H+)=__________ mol/L。
(3)利用反应Cu + H2O2 + H2SO4 = CuSO4 + 2H2O设计一个原电池,回答下列问题:
①负极材料为____________;正极反应式为__________________________。
②反应过程中SO42-向_______极移动。
③当电路中转移0.1mol电子时,电解液质量(不含电极)增加了______克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是 ( )
A.氯水中有平衡:Cl2+H2O![]() HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
B.对CO(g)+NO2(g)![]() CO2(g)+NO(g),平衡体系增大压强可使颜色变深
CO2(g)+NO(g),平衡体系增大压强可使颜色变深
C.对2NO2(g)![]() N2O4(g), 升高温度平衡体系颜色变深
N2O4(g), 升高温度平衡体系颜色变深
D.SO2催化氧化成SO3的反应,往往加入过量的空气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com