
【题目】(工业上采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4 , 主要流程如图1: 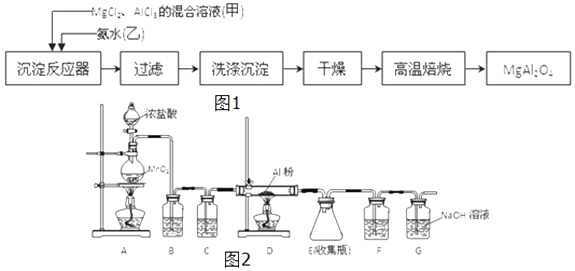
(1)写出沉淀反应器中生成氢氧化镁的离子方程式;
(2)判断流程中沉淀是否洗净的方法;高温焙烧时,用于盛放固体的仪器名称是;
(3)无水AlCl3遇潮湿空气即产生大量白雾而变质,实验室可用如图2下列装置制备. A中进行的化学方程式为;
装置B中的试剂是;F中试剂的作用是 .
【答案】
(1)Mg2++2NH3?H2O=Mg(OH)2↓+2NH4+
(2)取少量最后一次洗涤液,加入AgNO3溶液(或硝酸酸化的AgNO3溶液),若生成白色沉淀,则说明没有洗涤干净,若没有沉淀生成,则说明已经洗涤干净;坩埚
(3)MnO2+4HCl(浓) ![]() MnCl2+Cl2 ↑+2H2O;饱和食盐水;防止G中的水蒸气进入E中
MnCl2+Cl2 ↑+2H2O;饱和食盐水;防止G中的水蒸气进入E中
【解析】解:(1)沉淀反应器中氯化镁与氨水反应生成氢氧化镁,离子方程式为:Mg2++2NH3H2O=Mg(OH)2↓+2NH4+; 所以答案是:Mg2++2NH3H2O=Mg(OH)2↓+2NH4+;(2)沉淀中应该附着氯离子和铵根离子,若判断是否洗净,可以取少量最后一次洗涤液,加入AgNO3溶液(或硝酸酸性的AgNO3溶液)溶液进行判断,若生成白色沉淀,则说明没有洗涤干净;若没有沉淀生成,则说明已经洗涤干净,高温焙烧固体应在坩埚中进行,
所以答案是:取少量最后一次洗涤液,加入AgNO3溶液(或硝酸酸化的AgNO3溶液),若生成白色沉淀,则说明没有洗涤干净,若没有沉淀生成,则说明已经洗涤干净;坩埚;(3)由装置可知A中为二氧化锰与浓盐酸制备氯气的装置,发生的化学方程式为:MnO2+4HCl(浓) ![]() MnCl2+Cl2 ↑+2H2O;B中用饱和食盐水是为了除去混有的HCl气体;因为氯化铝易发生水解,故应该防止空气中的水蒸气进入E装置,G是吸收反应剩余的氯气.
MnCl2+Cl2 ↑+2H2O;B中用饱和食盐水是为了除去混有的HCl气体;因为氯化铝易发生水解,故应该防止空气中的水蒸气进入E装置,G是吸收反应剩余的氯气.
所以答案是:MnO2+4HCl(浓) ![]() MnCl2+Cl2 ↑+2H2O;饱和食盐水;防止G中的水蒸气进入E中.
MnCl2+Cl2 ↑+2H2O;饱和食盐水;防止G中的水蒸气进入E中.


科目:高中化学 来源: 题型:
【题目】黄钠铁矾[NaaFeb(SO4)c(OH)d]具有沉淀颗粒大、沉淀速率快、容易过滤等特点.某研究小组先将某废水中Fe2+氧化为Fe3+ , 再加入Na2SO4使其生成黄钠铁矾而除去铁.为测定黄钠铁矾的组成,该小组进行了如下实验:
①称取12.125g样品,加盐酸完全溶解后,配成250.00mL溶液A.
②量取25.00mL溶液A,加入足量的KI,再用0.2500molL﹣1Na2S2O3溶液滴定生成的I2(反应原理为I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00mL Na2S2O3溶液至终点.
③另取50.00mL溶液A,加入足量BaCl2溶液充分反应后,过滤,将所得沉淀洗涤、干燥后,称得其质量为2.330g.
(1)NaaFeb(SO4)c(OH)d中a、b、c、d之间的代数关系式为 .
(2)通过计算确定黄钠铁矾的化学式(写出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物 A,含 C、H、O 元素,其蒸气的密度是相同状况下氢气密度的30倍,其中氧元素的质量分数为26.7%,则该有机物的分子式为 . 为测定 A 的结构,作核磁共振氢谱,发现有三种吸收峰,且该物质可与金属钠反应,则A可能的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为94.5的有机物A,分子中含有一个羟基,在一定条件下可以发生如图所示的转化(其他产物和水已略去):I的核磁共振氢谱中峰面积之比为3:1:1:1,请回答下列问题: 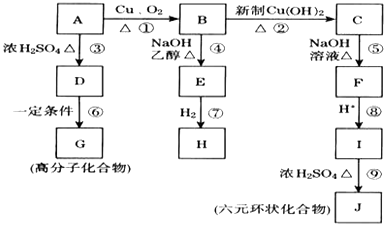
(1)写出下列物质的结构简式:A , I .
(2)上述①~⑨的反应中,是取代反应(填编号),是消去反应(填编号).
(3)写出下列反应的化学方程式:A→B;D→G;E与新制银氨溶液反应 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列物质的说法,正确的是( ) 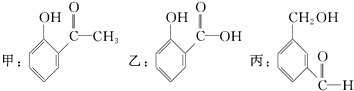
A.三者含有的官能团的种类相同
B.乙和丙中的﹣OH性质相同
C.甲和乙互为同分异构体
D.甲和丙互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,下列物质不能和二氧化硅反应的是( )
①焦炭 ②纯碱 ③碳酸钙 ④氢氟酸 ⑤氢氧化钾 ⑥氧化钙 ⑦氮气
A. ③⑤⑦⑧B. ③⑦C. ①④⑦D. ⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以黄铜矿(主要成分CuFeS2)为原料制备CuSO45H2O的主要流程如图: 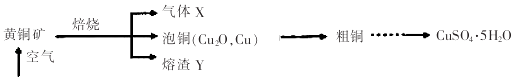
(1)下列装置不能用于吸收气体X的是(填代号). 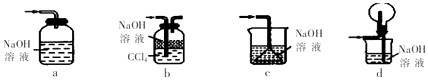
(2)熔渣Y的成分为Fe2O3和FeO,选用提供的试剂,设计实验验证熔渣中含有FeO.写出有关实验操作、现象与结论.
提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、氯水. .
(3)向粗铜中加入硫酸和硝酸的混酸溶液制取硫酸铜时(杂质不参加反应),混酸中HNO3与H2SO4的最佳物质的量之比为
(4)用滴定法测定所得产品中CuSO45H2O的含量,称取ag样品配成100mL溶液,取出20.00mL,用c mol.L﹣l滴定剂EDTA( H2Y2﹣)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂bmL.滴定反应如下:Cu2++H2Y2﹣=CuY2﹣+2H+ , 则CuSO45H2O质量分数为 . 滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏 . (填“偏高”、“偏低”和“无影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com